Le Nickel
Synthèse de 1000 tonnes de nickel haute pureté.

TABLE DES MATIERES
I. Le nickel
et ses applications
A. Les
minerais et les gisements de nickel dans le monde.[1]
B. Propriétés et
caractéristiques du nickel.[2]
I.2. Applications et utilisations du nickel
A. Les
normes et degrés de pureté du nickel
B.
Consommation et utilisations du nickel
D. Le
nickelage : deuxième besoin mondial de Ni[4]
II.
Production de 1000 tonnes de nickel haute pureté
A.
Présentation générale du procédé et de la société Eramet[5]
B. Le
procédé Eramet, un procédé hydrométallurgique performant.[5]
1 Attaque
de la matte par lixiviation
4 Découpage
des cathodes et conditionnement
C. Principe de l’extraction liquide liquide en continu
à contre courant.[6]
1 - Construction de Ponchon Savarit - conditions opératoires:
2 - Choix des solvants d’extraction et de
lavage : (extractants)
II.2.DIMENSIONNEMENT
DU PROCEDE.
A - Calcul du débit de solvant
B- Choix de
l’appareil d’extraction liquide liquide :
C-
Dimensionnement des mélangeurs décanteurs:
III. Aspects économiques, contrôle
qualité et QSE du projet
A) Analyse
de la qualité du nickel obtenu :
B) Aspect
sécurité risques et environnement :27
2- Toxicité
des solvants et des déchets:
C) Analyse économique
et comparaison au marchés actuels:
CONCLUSION……………………………………………………………………...……32
BIBLIOGRAPHIE ………………………………………………………………………33
Figure
1 : exploitation à ciel ouvert (minerai oxydé, en Nouvelle Calédonie)
Figure
2 : pays producteurs et réserves de nickel
Figure
3 : plaque de nickel haute pureté.
Figure
4 : Schéma par bloc des étapes d’extraction
Figure
5 : caractéristiques de l’usine ERAMET-SLN
Figure
6 : Développement du procédé
Figure
7 : Schéma par bloc de l’extraction par hydrométallurgie des différentes
impuretés
Figure
8 : diagramme de distribution
Figure
9 : conditions opératoires propres au nickel et au cobalt
Figure
10 : mécanisme d’extraction cobalt nickel
Figure
11 : Bilan et schéma de l’extraction
Figure 12 : Organigramme de sélection d’appareillage………………...……………………………20
Figure 13 : schéma
détaillé de l’extraction liquide liquide
Figure
14 : schéma par bloc global de la purification
Figure
16 : Dosage du fer et du Cobalt
LEXIQUE
Matte :
Les mattes de nickel sont des composés métalliques contenant en moyenne 75 % de nickel et 20 % de soufre. Elles sont aujourd’hui principalement destinées à l’usine Eramet de
Sandouville.
Ferronickels :
Les ferronickels sont des composés métalliques contenant en moyenne 25 % de nickel et 70 % de fer. Ils sont vendus sous forme de grenailles ou de lingots
Pyrométallurgie :
La pyrométallurgie est la technique traditionnelle d’extraction des métaux. Elle vise l’obtention de métaux pur à partir de leurs minerais ou de concentrés de minerais au moyen de techniques utilisant le feu.
EDTA :
HOOC-CH2 CH2-COO- acide éthylènediaminetétraacétique
Le
nickel est connu de l’Homme depuis des millénaires. Les hommes préhistoriques
se servaient déjà du nickel contenu dans les météorites pour réaliser des objets usuels. Il a été ensuite utilisé
pour la fabrication de pièces de monnaies au début de notre ère (sous forme de
cupronickel). Longtemps confondu avec l’oxyde de cuivre, il n’a été réellement
identifié et isolé qu’en 1751 par le chimiste suédois Alex Cronstedt.
Les débuts de la métallurgie moderne du nickel remontent en 1865, date où les français Garnier et Heurtaux découvrirent les ressources minières de la nouvelle Calédonie.
Les
premiers procédés thermiques de raffinage du nickel ont été mis au point dans
les années 1900, notamment le procédé Mond et le
procédé INCO. Vers 1950, de nouveaux procédés furent utilisés : les
procédés hydrométallurgiques (lixiviations
acides ou basiques) pour aboutir de nos jours à une part de marché égale pour
ces 2 types de traitements.
Dans un premier temps, nous nous attacherons à
présenter un bref aperçu des minerais et procédés existants. Ensuite nous
étudierons une des applications industrielles les plus importantes du
nickel : le nickelage, qui permet un dépôt de nickel sur des pièces
métalliques.
Nous présenterons, détaillerons et
dimensionnerons pour nos besoins (production de 1000 tonnes de nickel haute
pureté) un nouveau procédé hydrométallurgique, utilisé dans la seule usine de
traitement du nickel en France, et qui permet l’obtention d’une solution de
nickel pure directement utilisable pour le nickelage.
Nous
détaillerons donc en détail une étape d’extraction liquide - liquide nécessaire
pour une purification poussée du nickel,
ainsi qu’une étape de lavage et retraitement des solvants organiques utilisés.
A l’heure actuelle, il est très important de prendre en compte les contraintes
liées aux risques d’exploitation et aux contraintes économiques de l’industrie.
Nous
verrons ainsi au moyen d’une étude QSE (qualité-sécurité-environnement)
quels sont les dangers liés à la préparation du nickel, ainsi que les
retraitements et les revalorisations à effectuer aux cours du procédé. Nous
présenterons ensuite les méthodes qui permettent de s’assurer de la pureté et
de la qualité de notre nickel.
Une
étude économique nous montrera les coûts pour l’élaboration d’une tonne de
nickel pur, et nous permettra de comparer ce prix à celui du marché actuel.
I. Le nickel et ses applications
I.1. Présentation du nickel
A. Les minerais et les gisements de nickel dans le monde.[1]
Bien
que le nickel soit un des éléments les plus abondants dans l’univers, il n’est
que peu présent sur terre. Il figure en 28ème position des éléments les plus répandus, et
sa teneur ne représente que 0,008 % en poids de la croûte terrestre (le noyau
est la partie de la planète où l’on rencontre les plus fortes concentrations en
nickel). Le nickel élémentaire n’existe pas à l’état naturel, mis à part celui
provenant des météorites.
Les
minéraux et minerais qui contiennent du nickel en faible quantité (< 0,5%)
sont très répandus. Par contre les gisements exploitables sont plus
rares : la production de nickel vient essentiellement de deux types de
minerais : les minerais sulfurés et oxydés.
On
estime qu’approximativement 200 millions de tonnes de nickel sont disponibles
dans le monde, se répartissant entre 30% en minerais sulfurés et 70% en
minerais oxydés.
Cependant bien que les réserves de minerais sulfurés soient inférieures, leur exploitation est très développée puisque 55% des gisements en exploitation sont des minerais sulfurés. La pentlandite (34% de nickel : (Ni, Fe)9S8), qui renferme le nickel est généralement associée à d’autres minerais comme : la pyrrhotite (Fe7S8), la pyrite (FeS2) et la chalcopyrite (CuFeS2).
Ces minerais sulfurés sont essentiellement présents en Australie (district de Kampala), en Russie (Norilsk-Talnakh), en Chine, en Afrique du Sud (Bushveld), en Finlande, aux Etats-Unis (Stillwater, Montana) et au Canada, dans la mine de l'Ontario "Sudbury". Cette dernière représente la principale source d'extraction et l'une des plus grandes réserves mondiales de minerai tout-venant, la concentration en nickel y est d’environ 1,5%. L'extraction de ces minerais permet la récupération simultanée de "co-produits" qu'il est économiquement intéressant d'exploiter comme autres le cuivre, l'or, l'argent, des platinoïdes tels que le palladium et platine et le cobalt. Les minerais oxydés quant à eux, sont souvent exploités en surface, dans des mines à ciel ouvert.

Figure 1 : exploitation à ciel ouvert (minerai oxydé, en
Nouvelle Calédonie)
Contrairement aux minerais sulfurés riches en
sous-produits, les minerais oxydés ne contiennent généralement que du cobalt en
association avec le
nickel. La principale source d'extraction de ce type de minerai se situe
en Nouvelle-Calédonie où elle apparaît sous la forme de Garniérite : 3NiO,
3MgO, 2SiO2, 2H2O (concentration en nickel entre 3 et 5%
et contient outre MgO et SiO2 10 à 30% de
fer et cobalt). Une autre forme de minerai oxydé existe : les latérites
nickélifères (contenant entre 1 et 2% de nickel) dont les principales sources
se situent à Cuba, en Australie et en Grèce. Ainsi, le gabbro (0,016% de
Ni ; 16,6 % FexOy + MgO ; 66,6% SiO2 + Al2O3)
et la périodite (0,02% de Ni ; 43,3 % FexOy + MgO ;
45,6% SiO2
+ Al2O3) sont parmis les
minéraux sulfurés les plus répandus.
Toute la
problématique dans l’extraction du nickel d’un minerai est de trouver le
procédé qui sera le plus adapté à la nature du minerai. A l’heure actuelle il existe
dèjà plusieurs procédés différents exploités par de
grands groupes industriels. Nous allons développer uniquement l’un deux, en
l’occurrence le procédé utilisé par la société ERAMET SLN, qui traite en
France, au Havre, du minerai provenant de nouvelle Calédonie.
B. Les différents procédés d’extraction et de production du Ni
Il
existe une grande différence entre les gisements de minerais sulfurés et
oxydés : les minerais sulfurés sont exploités dans des mines souterraines
s’enfonçant jusqu’à 2000 mètres de profondeurs alors que les minerais oxydés
sont formés en surface et sont donc exploités à ciel ouvert.
Comme
nous l’avons mis en évidence, les gisements et minerais du nickel sont très
différents et inégalement répartis dans le monde.
Pour
cette raison il existe une grande diversité de procédés d’obtention de nickel . Ils dépendent principalement :
· du type de
minerai,
· des teneurs en
nickel (qui déterminent la voie de traitement hydrométallurgique pour minerais
pauvres et pyrométallurgique pour minerais riches)
· de la forme
sous laquelle se présentent le Ni.
Actuellement une vingtaine de procédés sont connus, dont environ 6 qui sont significatifs en termes de production : procédé INCO, Falconbridge, QNI, procédés cubains, Outokumu et ERAMET/SLN.
I.2. Applications et utilisations du nickel
A. Les normes et degrés de pureté du nickel
En plus des différentes
normes sur le nickel, des qualités commerciales sont utilisées pour classer le
nickel selon 5 catégories en fonction de son degré de pureté :
.le nickel
électrolytique ou nickel haute pureté : >99,95%
.le nickel
A : 99,4 % en moyenne dit nickel malléable
.le nickel
L : 99,4% métal doux pour
emboutissage
.le nickel
moulé : 97% à 1,6% de silicium
.le nickel
D, E, F de 95,2 à 97,5%contenant du manganèse de 2 à 4,5%.
Le système d'assurance qualité pour la production et la
commercialisation du nickel HP est certifié par deux organismes : l’un
international : ISO 9002 et l’autre Allemand : BVQI. et DIN.
à
Le nickel que nous souhaitons obtenir est du nickel haute pureté
B. Consommation et utilisations du nickel
Principaux pays
producteurs de nickel Principales réserves
mondiales de nickel
Depuis le milieu des années 1990, plus d'un million de tonnes
de nickel sont produites annuellement
(800 fois plus pour l'acier). Vingt pays, tous continents confondus l'exploitent
et vingt-cinq le raffinent et le fondent, ce qui fait de ce marché un secteur
relativement intégré. Cette concentration est encore plus notable au niveau des
entreprises. En effet, cinq grands groupes mondiaux fournissent plus de la
moitié de l'offre mondiale : Norilsk (Russie), INCO (Canada), Falconbridge (Canada), Western Mining
(Australie) et Eramet SLN (France); le reste provenant d'une trentaine de
petites sociétés disséminées tout autour du globe.

Figure 2 : pays producteurs et réserves de nickel
C. Le nickel haute
pureté[4]
Nous avons choisi
de détailler un procédé hydrométallurgique car dans ce cas, de nombreuses
étapes mettent en jeu un principe de la chimie contrairement aux procédés
thermiques.
De plus nous avons choisi un procédé
de synthèse de nickel de haute pureté de la société Sa dont l’usine est située
au Havre Sandouville en France, et qui est le leader mondial de production de
ferronickel (Ni à 75%) et très gros producteur de nickel haute pureté
Ce procédé de
traitement hydrométallurgique entièrement original, mis au point par le centre
de recherche du Groupe Sa, est un outil industriel parfaitement adapté à la
production de nickel de haute pureté ne contenant ni cobalt, ni fer, ni cuivre,
ni plomb, avec un niveau d'éléments traces extrêmement faible et des teneurs en
gaz basses. De ce fait, elle répond totalement aux exigences de pureté de plus
en plus élevées des industries à technologie avancée : industries aéronautique,
spatiale, électronique, nucléaire, production d'énergie, usines de dessalement
de l'eau de mer, construction de méthaniers, industries de traitement de
surfaces, etc. Le Cobalt contenu dans la matte est récupéré par ailleurs sous
la forme de sel.
Le nickel haute
pureté (ou nickel électrolytique) obtenu se présente sous forme de plaques dont
les dimensions sont soit de 100 x 100 mm, soit de 50 x 50 mm.

Figure 3 : plaque
de nickel haute pureté
D. Le nickelage : deuxième besoin mondial de Ni[4]
1. Les principales
utilisations du nickel haute pureté :
·
les superalliages
·
les alliages à propriétés physiques particulières
·
les électrodes de soudure
·
la fabrication de flans monétaires
·
la galvanoplastie ou nickelage
·
la sidérurgie : élaboration d'aciers inoxydables et
réfractaires à très basse teneur en cobalt pour applications
nucléaires
2. Principe et fonctionnement du nickelage :
Le nickel possède comme qualité d'être inoxydable à l'air dans des conditions normales et d'offrir un bel éclat. Il peut donc être employé afin de galvaniser - nickeler - des pièces en fer (qui s'oxydent à l'air), en cuivre ou en laiton (qui perdent facilement leur éclat).
Il existe plusieurs méthodes qui permettent un dépôt de nickel : le nickelage chimique et le nickelage électrolytique. La différence majeure tient à l’apport des électrons dans le processus rédox. Pour le premier, ils proviennent de l’oxydation d’un réducteur présent en solution, et pour le second ils sont apportés par un courant. Nous présenterons ici une vrève approche du nickelage chimique beaucoup plus accessible que le nickelage électrochimique.
Le nickelage chimique est une technique qui permet le dépôt de nickel par réaction électrochimique à l’interface de la pièce métallique et de la solution contenant le nickel. Le procédé présenté ici est celui par réduction chimique. Les électrons nécessaire pour la réaction de réduction du nickel en solution proviennent de l’oxydation d’un agent réducteur en solution , en l’occurrence l’hypophosphite de sodium :
Réduction : Ni 2+ + 2 e - ® Ni (dépôt)
Oxydation : H2P02-
+ H2O ®
H2P03- + 2H+ + 2 e –
Il existe cependant certaines réactions parasites comme la réduction des protons pour former de l’hydrogène qui change le bilan global de la réaction rédox du dépôt. On obtient finalement :
3 H2P02- +3 H2O + Ni 2+ ® 3H2P03- + 2H+ + 2H2 + Ni (dépôt)
Expérimentalement, on s’aperçoit qu’il faut en fait 2,7 moles d’hypophosphite pour une mole de nickel. En effet il existe une réaction parasite de formation de phosphore :
H2P02-
+ ½ H2® P + OH-
+ H2O.
Le bain de nickel dans lequel se produit la réaction d’oxydo réduction est en équilibre métastable : la réaction ne se produit pas spontanément mais seulement en présence de catalyseur.
Or le nickel, appartenant aux éléments du huitième groupe possède une orbitale vacante au niveau d. A ce titre, il fait parti de la classe des catalyseurs. Ainsi, le nickel est un autocatalyseur et l’épaisseur des dépôts ne fait que croître avec le temps. Le nickel impliqué dans ce type de réaction est sous forme ionique dans une solution aqueuse. Il peut avoir différents ligands : NiCl2, 6 H2O ou NiS04, 6 H2O. La formulation d’un bain de nickelage dépend des caractéristiques recherchées comme l’épaisseur du dépôt et la pureté de la couche.
Des agents complexants tels que l’acide glycolique sont ajoutés pour éviter la précipitation de orthophosphite de nickel, peu soluble. En effet, selon le domaine de pH dans lequel se trouve le bain, il est possible qu’il y ait précipitation. Le pH est un paramètre très important puisqu’il conditionne l’activité du bain ( vitesse de dépôt). Pour le réguler, on additionne dans le bain de la soude ou de l’ammoniaque.
Le
dépôt de nickel chimique peut s’effectuer sur de nombreux supports (les fontes,
les aciers inoxydables, les alliages d’aluminium ou de cuivre, l’or , l’argent, le titane, l’uranium, le palladium, les
céramiques, le verre…).
Selon
la nature du substrat, le traitement sera adapté pour débuter la
réaction :
·
Substrat catalytique : la réaction démarre dès l’immersion de la pièce
et continue normalement. L’épaisseur du dépôt est fonction du temps
d’immersion.
-
dans un état d’immunité (aucune tendance à s’ioniser) : on amorçe la réaction par une légère polarisation
cathodique dans le bain lui même ou par
contact avec un métaux moins noble ; le dépôt continue ensuite de
lui même.
-
Avec un potentiel rédox inférieur au potentiel du métal déposé :
il se produit naturellement une réaction de déplacement de métal catalytique et
la réaction se poursuit ensuite d’elle même.
·
Substrat non conducteur : sensibilisation et activation de la surface
du substrat par le palladium, métal particulièrement actif sur le plan
catalytique.
Certains métaux, comme le plomb, le zinc, le
bismuth, le cadmium, l’antimoine et l’étain, ne peuvent pas être traité
directement car leur présence à l’état de trace arrête la réaction. (A ce titre
les soudures présentes sur les installations de bains de nickelage demandent
des soins spéciaux) Néanmoins, en les recouvrant électrolytiquement d’un autre métal (par exemple le cuivre) il
devient possible de les revêtir de nickel chimique.[4]
II. Production de 1000 tonnes de nickel haute
pureté
A. Présentation générale du procédé et de la société Eramet[5]
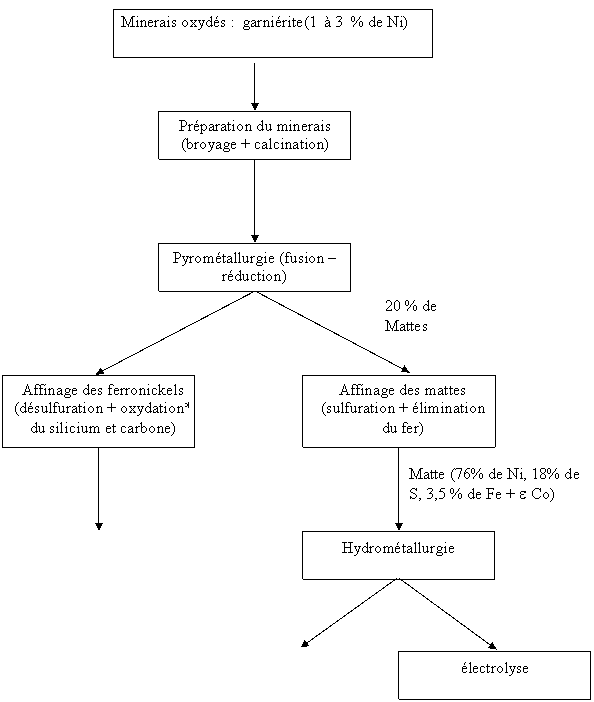
80 % de Ferronickel brut Ferronickel
affiné
Figure 4 : Schéma par bloc des étapes d’extraction
du nickel
de la garniérite pour la fabrication
de nickel haute pureté pour nickelage
Solution
commerciale de NiCl2 pour
nickelage

|
Superficie
de l'usine |
16
ha (200 personnes) |
|
Surface
couverte |
18
500 m² |
|
Capacité
de production |
13 000 t/an de nickel électrolytique
de haute pureté |
|
|
3
000 t/an de nickel sous forme de chlorure de nickel cristallisé et en solution |
|
Autres
produits |
300
t/an de cobalt sous forme de chlorure de cobalt |
La
société Eramet exploite plusieurs
gisements situés en Nouvelle Calédonie et traite le nickel dans deux
usines : une à Doniambo et l’autre en France, au Havre Sandouville. Cette
usine fabrique la totalité du nickel haute pureté Sa, soit 13000 tonnes de
nickel haute pureté par an. Eramet-SLN est le 1er producteur mondial de
chlorure de Ni.
Figure 5 : caractéristiques de l’usine ERAMET-SLN
B. Le procédé Eramet, un procédé
hydrométallurgique performant.[5]
Figure 6 : Développement du procédé 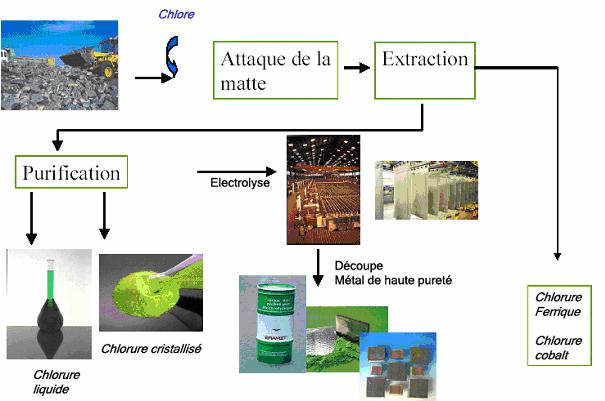
L’hydrométallurgie*
est une des deux des méthodes de métallurgie extractive. Cette méthode est peu
coûteuse en énergie, permet de traiter des minerais pauvres et peut s’effectuer
dans de petites unités. Elle est en fort
développement actuellement et à pris le pas devant la seconde méthode de
métallurgie extractive : la pyrométallurgie*,
qui ne présente pas ces avantages.
Le
schéma général d’un traitement hydrométallurgique comprend 4 étapes :
- Lixiviation = mise en
solution du minerai (attaque acide, basique, oxydante…)
- Purification :
extraction de la solution des impuretés et autres métaux
- Elaboration du métal
désiré (pour nous le nickel)
- Raffinage du métal (à
Sandouville, par électrolyse)
Il
faut rappeler que le processus d’élaboration du nickel de haute pureté n’est qu’un étape d’une longue chaîne de travail qui commence par
l’extraction des minerais puis
par la formation des ferronickels et de la matte à 75% de Ni dans l’usine de
Doniambo en Nouvelle Calédonie. Cette matte est transportée en France puis
traitée à Sandouville.( cf figure7)
1
Attaque de la matte par lixiviation
La
lixiviation est réalisée en milieu acide chlorhydrique
·
La matte
contenant du nickel, cobalt, fer et soufre est d'abord broyée finement,
puis attaquée par une
solution de chlorure ferrique en présence de chlore dans un ensemble de
réacteurs. Le nickel, le cobalt et le fer sont transformés en chlorures et passent en solution tandis que le soufre qui à l'état élémentaire est éliminé lors de cette
opération et récupéré.
·
La solution
de chlorures de nickel, cobalt et fer est séparée du soufre et des
résidus
insolubles grâce à un filtre et subit alors des étapes successives d'extraction
et de purification.
Après
décantation la solution contient 200 g/l de Ni 5 g/L de Co
10 g/L de Fe. La purification du nickel est réalisée
par extraction liquide liquide. Il s’agit de l’étape
principale de la purification, elle se
passe dans les conditions suivantes.
2
Extraction liquide liquide
·
Extraction du
fer
L'extraction du fer et des métaux
parasites est obtenue grâce à
l'utilisation d'un
solvant organique sélectif, le tributylphosphate, mis en contact avec la solution dans la
batterie d'appareils mélangeurs décanteurs fonctionnant à contre-courant. La
solution de FeCl3 est recyclée, l'excès est commercialisé et utilisé
dans le traitement de l'eau potable.
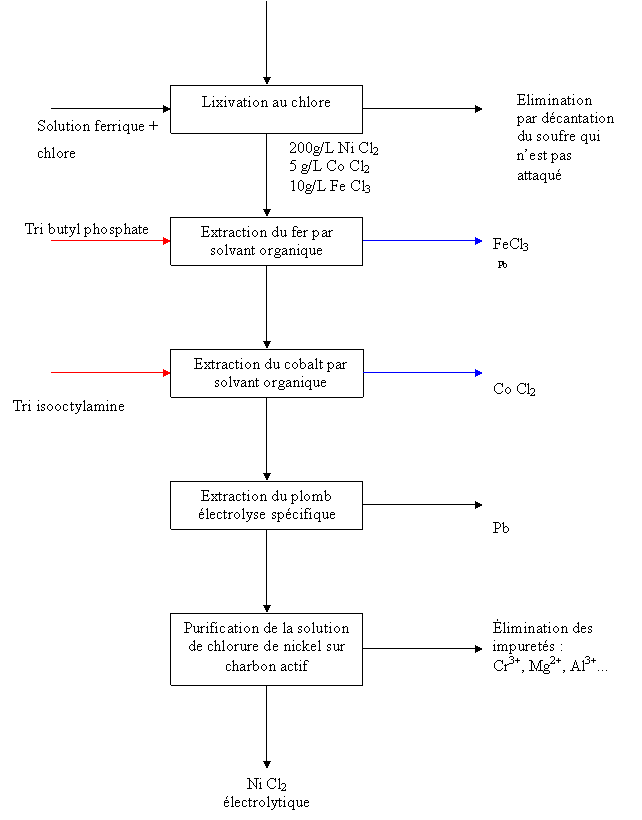
Figure 7 : Schéma par bloc de l’extraction par
hydrométallurgie des différentes impuretés
- Extraction du cobalt
Pour extraire le cobalt de la
solution de chlorures de nickel et de cobalt maintenant débarrassée du fer, on
applique le même principe que précédemment dans une autre série de mélangeurs
décanteurs à l'aide d'un solvant différent, la triisooctylamine.. On obtient
ainsi une solution de chlorure de cobalt pure et une solution de nickel ne
contenant plus de cobalt.
Nous allons détailler le principe de cette
opération, dimensionner les mélangeurs pour les quantités que l’ont souhaite
produire (1000 tonnes par mois)
La solution purifiée de chlorure de
nickel est envoyée dans une série de cuves d'électrolyse. Celles-ci comportent
des anodes insolubles régénérant le chlore; le nickel métal se dépose à la
cathode, sur des feuilles mères en nickel.
On obtient ainsi une cathode épaisse
de nickel pur à très basse teneur en cobalt et avec des niveaux d'impuretés
extrêmement faibles.
Pour
les besoins spécifiques de certaines industries (nucléaire, aérospatiale,
etc.), les cathodes subissent un recuit éliminant totalement l'hydrogène.
4
Découpage des cathodes et conditionnement
Avant
leur expédition, les cathodes de nickel sont découpées par cisaillage pour
obtenir des carrés de 100 x 100 x 14 mm, adaptés aux besoins des industries
métallurgiques, ou des carrés de 50 x 50 x 14 mm.
Enfin, les carrés sont enfûtés sur
chaînes automatisées dans des fûts en acier de 200 ou 250 kg et palettisés par
1200 kg ou 1500 kg.
L'identification des lots et la
dimension des produits sont clairement marqués sur les fûts, ceux-ci étant
ensuite plombés pour l'expédition.
C.
Principe de l’extraction liquide liquide en continu à contre courant.[6]
1
- Construction de
Ponchon Savarit - conditions
opératoires:
L’extraction
du cobalt se déroule en 3 étapes :
- extraction liquide
liquide (raffinat riche à 98% de nickel)
- lavage du solvant (afin
de le réutiliser)
- désextraction
L’extraction
liquide liquide est l’étape principale du procédé. Elle nous permet d’obtenir
la solution de nickel pur. Les opérations de lavage et de désextraction sont
des étapes secondaires mais indispensables au procédé pour ne pas perdre de
nickel ni de solvant.
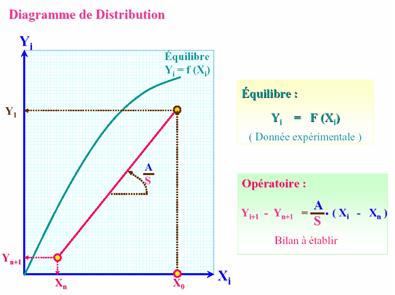
Figure 8 : diagramme
de distribution
La courbe d’équilibre en bleue représente l’équilibre entre
le cobalt dans la phase aqueuse
- Yi : fraction de cobalt dans la phase organique
(extrait)
- Xi :
fraction de cobalt dans la phase aqueuse (raffinat)
Dans le cas ou nous opérons le cobalt est de 5% massique est
la courbe d’équilibre est alors considérée comme une fonction affine de pente
D=A/S = 2
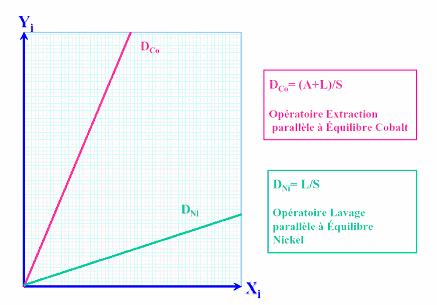
Figure 9 : conditions
opératoires propres au nickel et au cobalt
Le compartiment d’extraction se symbolise schématiquement
par un rectangle de 1 à n étages.
2
- Choix des solvants
d’extraction et de lavage : (extractants)[5]
Les
solvants d’extractions doivent :
·
être immiscibles avec le diluant (eau acide)
·
être sélectifs vis-à-vis de l’espèce à extraire (ici le
cobalt)
·
avoir une capacité d’extraction convenable (coef de distribution K)
Les extractants sont répartis en 4 catégories et
circulent en contre courant par rapport à la solution de chlorures:
·
agents solvatants
·
échangeurs d’anions
·
échangeurs de cations
·
agents chélatants
Le tributyl phospate
est un agent solvatant cationique qui permettra d’effectuer l’extraction de
cation Co2+ tout en ayant une sélectivité suffisante pour ne pas
solvater le Ni2+.
Le mécanisme d’action de ce solvant est le suivant :
![]()
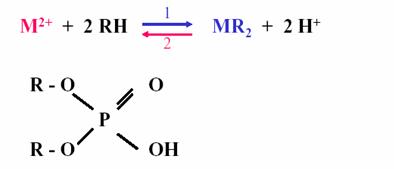
Figure 10 : mécanisme d’extraction cobalt nickel
Les débits de solvants seront déterminés par la pureté en
cobalt désirée en sortie du compartiment de l’extraction. Le lavage est
effectué par de l’eau.
II.2.DIMENSIONNEMENT DU PROCEDE.[7]
Apres plusieurs traitements, et notamment l’élimination du Fer à l’aide d’un solvant organique spécifique, le tributylphosphate, on obtient une solution aqueuse qui ne contient que du cobalt et du nickel. Le Cobalt est à son tour extrait de la solution par un autre solvant, la tri-isooctylamine. Ce solvant a pour avantage d’extraire uniquement le cobalt et pas le nickel, d’autre part il est non miscible avec l’eau.
La solution qu’on doit séparer contient alors 93% de Ni et 7% de Co. Nous choisissons d’effectuer une extraction à contre courant.
La pureté de la solution qu’on désire finalement obtenir est de 99% en Ni.
A - Calcul du débit de solvant
Droite d’équilibre :
Nous savons que le coefficient de distribution du Cobalt est D = 2 pour les deux solvants utilisés, Et D = XRéq / XEéq
On peut ainsi tracer la droite d’équilibre du Co entre ces deux solvants : XRéq = 2 XEéq
Bilan sur le Co :
 S En Ei E1
S En Ei E1
n i 1
Rn Ri R1 A
Bilan : XE1 E1 + XRn Rn
= XS S + XR0 R0 (R0 = A)
Figure 11 : Bilan et schéma de
l’extraction
Or les deux solvants ne sont pas miscibles donc :
R0 = R1 = … = Rn = A
E1 = E2 ... = En-1= S
Sachant que XS = 0
On obtient :
XE1 S
= XR0 A – XRn A
XE1
= ( XR0 – XRn ) A/S
Calcul de l’opératoire limite ;
On veut travailler avec un débit d’alimentation A = 30m3/h, dont la composition XR0 = 0,07 et on veut obtenir XRn = 0,01.
Pour calculer Smin il faut trouver (A/S) max . On trace la droite opératoire passant par le point (XRn = 0,01 ; 0) et qui coupe la droite d’équilibre au point d’abscisse XR0 = 0,07.
La pente de cette droite correspond a (A/S) max et on en déduit
Smin = 13
m3/h , d’où S = 20 m3/h
Calcul de l’opératoire et du NET :
On peut alors calculer la pente de l’opératoire de notre extraction : A/S = 1,5
On trace l’opératoire et on détermine le nombre d’étages théoriques (NET) dont on a besoin en utilisant la méthode de Mc Cabe & Thiele. On trouve NET = 4
B- Choix de l’appareil
d’extraction liquide liquide :[7]
Le choix de l’extracteur est basé sur plusieurs critères qui nous permettent d’évaluer les paramètres de notre extraction. Nous noterons principalement les volume qu’on désire traiter ainsi que le type d’émulsion a laquelle on a affaire et le nombre d’étages théoriques qu’on a préalablement calculé.
oui Faible hauteur oui oui Colonne tout types – extracteur centrifuge Mélangeur décanteur – extracteur
centrifuge Extracteur centrifuge Colonne pulsée extracteur Grassmer Mélangeur décanteur extracteur Grassmer Figure 12 : Organigramme de sélection
d’appareillage non Etage théorique NET >5 non oui oui Faible surface Faible hauteur oui oui non non Etage théorique NET <5 Emulsion stable Volume réduit Procédé
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
En général, l’efficacité des mélangeurs-décanteurs n’est pas éloignée d’un étage théorique de séparation, donc pour une application nécessitant un nombre d’étages théoriques déterminé, il suffit de concevoir le même nombre de mélangeurs-décanteurs.
Les principaux avantages de l’utilisation de ce type d’extracteur sont :
- La possibilité de contrôler le rapport de phases
- La possibilité de contrôler la dispersion en jouant sur l’intensité d’agitation
- Le temps élevé de contact entre les deux phases
On prévoie donc d’utiliser 4 mélangeurs-décanteurs en série fonctionnant à contre courant. On utilise ainsi moins de solvant qu’avec un système de courants croisés, tout en étant assuré d’avoir une bonne extraction.
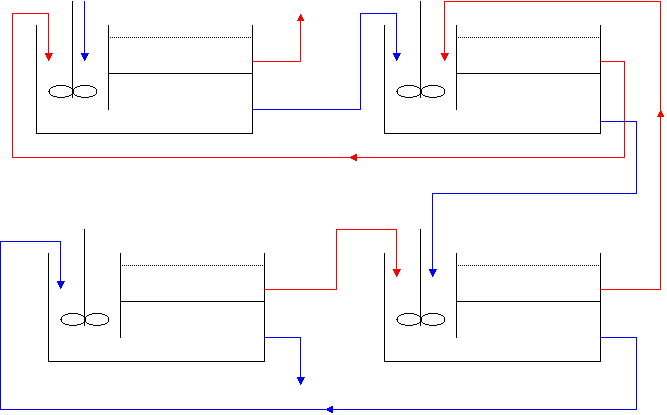 A2 A E1 R1
E3
A2 A E1 R1
E3
R2
E4
R3
R4
Figure 12 : schéma détaillé de l’extraction liquide liquide
![]() Légende : Phase organique[7]
Légende : Phase organique[7]
![]() Phase aqueuse[8]
Phase aqueuse[8]
Au cours de ce procédé nous récupérons le
sous-produit de l’extraction. La phase qui nous intéresse est le raffinat R4,
c’est une solution qui contient 99% de nickel. L’extrait E1 est la
phase qui contient le cobalt extrait, et une légère quantité de nickel (environ
9%).
C-
Dimensionnement des mélangeurs décanteurs[8]
Dans ce type d’appareil l’opération de mélange peut être effectuée soit par agitation mécanique dans un réservoir agité, soit par l’utilisation d’un mélangeur statique qui utilise l’énergie de perte de charge des fluides en mouvement. En général on utilise des mélangeurs statiques dans l’industrie du Nickel.
Il existe plusieurs types de décanteurs tels les coalesceurs, les décanteurs centrifuges ou les décanteurs gravitaires qu’on va utiliser.
La construction d'un décanteur met donc en pratique cette faculté de décantation à faible vitesse. En tranquillisant le mélange, on laisse le temps aux particules de se déposer dans le fond du bac. On utilise des décanteurs allongés horizontaux. En considérant que la vitesse de sédimentation est de 10 cm.min-1 on peut estimer le temps de séjour des particules en fonction de la hauteur du bac. Pour une hauteur de 1,5 m on trouve un temps de séjour 15 min. On est ainsi capable de calculer le volume du décanteur en fonction du débit entrant.
On obtient un volume de 12,5 m3, d’où une surface de 8,4 m2. On multiplie cette section par 1,3 (facteur de sécurité) et on trouve finalement une surface de 11 m2.
Le principal inconvénient des mélangeurs-décanteurs classiques est la grande surface qu’ils occupent, et donc ils engendrent un grand encombrement volumique. On a donc été conduits à trouver des systèmes qui soient aussi efficaces mais qui soient moins encombrants. Nous avons donc choisi de travailler avec un produit de la société Krebs, qui propose un mélangeur muni d’une pompe à pales radiales trapézoïdales qui, par effet centrifuge, initie la séparation des phases des la sortie du mélangeur et réduit de 50 à 75% la surface nécessaire du décanteur. Donc finalement on utilise une agitation mécanique, contrairement à ce qui avait été prévu au départ, et la surface du décanteur est ainsi réduite à 5 m2. Etant donné que nous travaillons avec un nouveau type de mélangeur, les dimensions géométriques du mobile d’agitation et de la chambre de mélange, ainsi que la puissance de l’agitateur, seront déterminées avec l’aide du constructeur, en l’occurrence Krebs, à partir des résultats obtenus sur le prototype, par similitude hydrodynamique, à énergie spécifique d’agitation constante. Ce type d’extrapolation, s’il n’est pas le plus économique, conduit à des appareils industriels d’efficacité supérieure à celles des appareils extrapolés.
Ce procédé nous permet théoriquement d’obtenir une bonne extraction du cobalt, qui peut être améliorée par l’ajout d’un étage théorique (un mélangeur-décanteur), mais en refaisant le calcul sur l’extrait nous remarquons que celui-ci contient encore beaucoup de nickel. Donc la séparation est mauvaise et il faudrait alors prévoir d’extraire ce composé. En effet ceci pose plusieurs problèmes, premièrement on perd une partie du nickel, deuxièmement la présence de nickel dans le solvant peut causer des problèmes lors de la régénération de ce dernier ainsi, qu’au niveau de la récupération du cobalt qui est un sous-produit valorisable. On effectue alors une opération de lavage qui permettrait de récupérer le nickel. Donc à la sortie de l’extraction, nous récupérons le solvant chargé en cobalt et une petite quantité de nickel, qu’on mélange à nouveau à de l’eau afin de récupérer le nickel. Ceci veut dire l’ajout d’un mélangeur-décanteur dans la chaîne de production. La phase aqueuse sortant de ce mélangeur-décanteur (c'est-à-dire le raffinat de l’opération de lavage), est mélangée à l’alimentation de l’extraction.
La phase organique sortant de l’opération de lavage (l’extrait) est récupérée. Il faut prévoir alors une unité de désextraction qui permettrait de régénérer le solvant utilisé d’une part, et de récupérer le cobalt d’autre part afin de pouvoir le valoriser.
Le schéma du procédé devient donc :
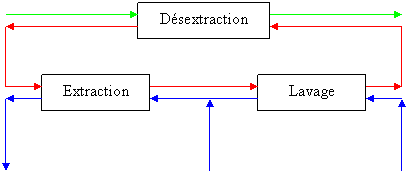 Solvant désextraction (0,0) Extrait
(Co)
Solvant désextraction (0,0) Extrait
(Co)
S
Extrait (Co)
Raffinat (Ni) Alimentation Eau
(Co + Ni)
Figure 134 : schéma par bloc global de la purification
Le produit que nous récupérons en sortie du procédé est le raffinat contenant 99% de nickel. Comme les deux phases sont non miscibles le débit de nickel est alors égal au débit d’alimentation soit 30m3 par heure, donc 30 tonnes par heure de solution de nickel.
III. Aspects économiques,
contrôle qualité et QSE du projet
A. Analyse de la qualité du nickel obtenu :
Pour
déterminer la concentration de la solution de nickelage, on réalise un dosage complexométrique. Il s’agit d’une méthode basée sur la
formation d’un complexe entre l’ion Ni 2+ avec une molécule chélatante :
l’EDTA* (acide éthylènediaminetétraacétique notée H2Y2-)
Cette molécule possède 6 sites potentiels de liaisons : les 4 groupements carboxyliques et les 2 fonctions amines. On travaille généralement en milieu basique à pH = 10 pour obtenir les 2 bases conjuguées des 4 groupements acides. Dans la prise d’essai de l’échantillon à doser, on introduit alors un large excès de NH4OH, ainsi que de la murexide (purpurate d’ammonium de couleur violette et notée Mu-) pour servir d’indicateur coloré. La totalité de la murexide se complexe. L’ion purpurate forme avec le nickel un complexe de couleur jaune :
Ni 2+ +
Mu- ® NiMu+
Une solution commerciale d’EDTA est utilisée pour servir de solution titrante. Lorsqu’on l’introduit dans le mélange à doser, il y a destruction du complexe NiMu+ et formation du complexe Ni Y2- .
NiMu++ H2Y2- ® Ni Y2- +2H ++ Mu-
L’ion nickel se complexe également avec l’EDTA pour donner une solution de couleur bleue tel que : Ni 2+ + H2Y2-® Ni Y2- +2H +
Il y a donc libération de l’ion purprate qui donne une couleur violette à la solution. A l’équivalence, il y a donc passage d’une couleur orangée à une couleur violette.
Exemple de dosage employé pour doser une solution commerciale de nickel (référence commerciale : BARRET SNR 24 ) distribué par la société McDermid/Frappaz :
Dans un erlemmeyer de 250 mL, verser exactement 1 mL de solution. Introduire ensuite environ 10 mL de NH4OH avec quelques grains de murexide. Doser la solution avec une solution d’EDTA jusqu’à l’obtention de la coloration violette.
Résultat : T Ni 2+ = Véq * 5,88 (g/L)
Ce type de dosage permet de connaître la teneur en nickel de la solution de chlorure de nickel destinée au nickelage. Néanmoins pour vérifier qu’il s’agit bien d’une solution pure et qu’elle ne contient plus d’impuretés il s’avère que cette méthode est inadéquate. Pour connaître la concentration de métaux en solution à l’état de trace, on utilise la spectrométrie d’absorption atomique.
L'absorption atomique [9] est une méthode générale d'analyse élémentaire. Lorsqu’on chauffe suffisamment un échantillon contenant le métal étudié sous forme dissoute, celui-ci se vaporise et une partie des éléments constitutifs de cet échantillon se retrouve sous forme d'un gaz d'atome. Les atomes libres vont alors être excités (passage d’un état fondamental EF à un état excité EI) par apport d’une énergie lumineuse (hn) provenant d’une source de radiation. On utilise pour cela une lampe à cathode creuse formée d'une coupelle (la cathode) du métal recherché surmontée d'une pointe portée à un potentiel très positif, le tout dans de l'argon à très basse pression.
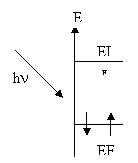
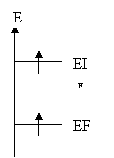
Figure 145 :Condition pour avoir transition électronique par
absorption d’énergie lumineuse pour la quantification des particules
On
mesure la concentration d'un atome d'un élément particulier de ce gaz par
l'absorption qu'il induit sur un rayonnement d'une longueur d'onde
caractéristique.
La relation de Beer-Lambert A=elC permet de mettre en relation
l’absorbance A (caractéristique du composé étudié) avec la concentration C de
l’analyte.
Il existe parfois
des interférences avec des composés qui absorbent à la même longueur d’onde que
l’analyte à doser. On a alors recourt à une lampe au
deutérium qui permet de les corriger.
Remarque : La technique d’absorption
atomique permet de déterminer la qualité d’une eau potable. En effet, elle
donne la possibilité de quantifier les différents métaux (Ni, Fe, Zn, Cu...) . A ce titre, la présence de nickel n’est pas une
source d’interférence même en très large quantité, car seule intervient les zones
d’absorptions d’énergie.
Dans notre cas,
pour vérifier que le cobalt et le fer sont présents à l’état de traces dans la
solution de chlorure de nickel, on réalisera deux études :
-
une
droite d’étalonnage avec une solution commerciale de cobalt et une lampe de
cobalt
-
une
droite d’étalonnage avec une solution commerciale de fer et une lampe
d’émission de fer fournit par le constructeur de
l’appareil.
On estime qu’une
solution de nickel est pure à environ 99,97 % et contient environ 200g/L de
nickel. On en déduit que la teneur des impuretés est de l’ordre de : 0,06
g/L . On considère que le fer et le cobalt sont
présents en même quantité (ce qui n’est pas le cas) ,
ce qui donne une teneur d’environ 30 ppm pour chaque
composé. Pour obtenir les droites d’étalonnage, on utilisera 5 solutions de
concentrations connues qui encadreront cette valeur. (On prendra par exemple
10, 15, 25, 35 et 50 ppm). Ces solutions sont
préparées par dilution d’une solution commerciale étalon de chaque composé.
Remarque :
sur certains spectromètres, la limite de quantification [10] est de
l’ordre de 3 ppm. Pour pouvoir estimer précisément la
teneur, on effectue alors une dilution de la solution. On aura alors à
multiplier la valeur déterminée par spectrométrie par le facteur de dilution.
L’étalonnage
permet d’obtenir une droite qui traduit la concentration de l’analyte en fonction de l’absorbance. On peut ainsi doser la
quantité de cobalt ou de fer contenue dans notre solution grâce au programme du
spectromètre (il utilise les relations de Beer-lambert
et Maxwell-Boltzmann qui traduisent l’intensité de
l’absorbance en concentration de l’analyte).
Signal
![]()
a1
![]()

ao
Avec [11]
: a1
= pente ou sensibilité
ao = intersection à l’origine ou blanc
analytique
LD
= limite de détection
C
LQ = limite de
quantification
![]() sbl = écart type du blanc
sbl = écart type du blanc
Figure 156 : Dosage du fer et du Cobalt
B. Aspect sécurité risques et environnement : [12]
On peut considérer que les risques d’incendie liés à la production de nickel sont pratiquement inexistants. En effet, les principaux produits utilisés sont très peu inflammables.
Le nickel, le nitrate de nickel ainsi que tous les composés minéraux courant du nickel sont extrêmement peu inflammables. Il faut néanmoins noter l’existence de forme pyrophorique du nickel en poudre qui, au contact d’un matériau combustible, il peut provoquer un feu ou en accroître l’intensité.
Le point d’éclair du phosphate de tributyle est de 166°C. En cas d’incendie, on préconise l’extinction par le dioxyde de carbone ou une mousse. De plus les fumées émises par une telle combustion sont nocives et toxiques.
Le trichlorure de fer est tout à fait ininflammable mais peut être une source secondaire d’incendie. En fait il provoque lors de l’attaque des métaux un dégagement d’hydrogène, gaz très inflammable et explosible.
2- Toxicité des solvants et des déchets:
a -
Nickel
a1
- L’homme au travail :
-Toxicité par ingestion orale :
L’ingestion de nickel ou de ses composés en quantité importante ne peut-être qu’exceptionnelle et n’a fait l’objet que de quelques cas recensés dans l’industrie. Elle n’a jamais eu de conséquences graves. Les quantités nécessaires pour atteindre la dose létale sont si importantes que le nickel et ses composés ne sont pas considérés comme très toxiques.
Les composés solubles dans l’eau (les
sels de nickel : sulfates, chlorures, nitrates, sulfamates)
sont les formes les plus actives, les composés insolubles (carbonates,
hydroxydes, oxydes, sulfures) peuvent être considérés comme sans danger, de ce
point de vue.
-Toxicité par contact cutané – Allergie de contact et
respiratoire :
L’élément nickel est un sensibilisant reconnu au regard de l’allergie de contact. Le risque d’allergie de contact (eczéma des mains…) peut être observé dans des ateliers où sont manipulés sans précaution des sels solubles de nickel.
-Toxicité par inhalation :
>Toxicité aiguë : Il n’existe qu’un composé du nickel, le nickel carbonyle, connu pour sa toxicité aiguë. C’est un gaz pour lequel la dose létale est relativement faible, mais dont la stabilité dans les conditions ambiantes est également extrêmement faible, ce qui limite considérablement le risque. Le nickel carbonyle est formé à basse température en conditions réductrices ; il est industriellement utilisé dans trois usines dans le monde comme intermédiaire de la purification du nickel (2 usines INCO, 1 en Russie).
>Toxicité à long terme : Voici les principales conclusions d’un rapport publié en 1990 par le « Comité International sur la Cancérogénèse du Nickel chez l’Homme » :
.les excès de cancers ne sont rencontrés que dans le cadre de certaines séquences de procédés de raffinage du nickel, procédés aujourd’hui obsolètes ,
.les excès de cancers sont liés à l’exposition aux formes solubles, pas aux formes métalliques,
.les excès de cancers ne sont observés que pour des concentrations supérieures à 10mg/m3 de nickel sous forme peu soluble et à 1mg/m3 de nickel sous forme soluble.
a2 - Le consommateur
-Allergie de contact :
Le seul risque que peut présenter le nickel pour les consommateurs est l’apparition d’allergie résultant d’une exposition cutanée directe et prolongée. Ces conditions peuvent se rencontrer dans la vie courant lors de l’usage de bijoux fantaisie (essentiellement des boucles d’oreille), de certains de montres ou de rivets de jeans.
b - Solvant :
tributylphosphate (TBP)
>Toxicité aiguë : Le phosphate de tributyle est irritant pour la peau et les muqueuses oculaires et respiratoires, mais uniquement dans le cas de TBP concentré.
>Toxicité chronique : Des contacts cutanés répétés ou prolongés avec le produit peuvent entraîner des dermatoses irritatives, des nausées.
c -
Solution d’acide concentrée (FeCl3)
Le trichlorure de fer entraîne des troubles digestifs importants (douleurs abdominales, vomissements, diarrhées et gastrites hémorragiques). Une ingestion importante pourrait provoquer une nécrose de l’estomac, une acidose métabolique, une atteinte tubulaire rénale aiguë, des troubles de la coagulation, une cytolyse hépatique et pourrait même amener à un coma convulsif.
Le contact avec la peau peut entraîner des dermites persistantes ou une pigmentation brune qui subsiste quelques jours. L’inhalation des vapeurs émises lorsque la substance est chauffée provoque une irritation susceptible de léser les muqueuses respiratoires.
Pour l’eau, les procédés hydrométallurgiques ont un impact environnemental non négligeable à prendre en compte. Les installations hydrométallurgiques sont d’ailleurs considérées comme des installations classées ; leurs rejets sont donc soumis à autorisation et contrôlés régulièrement.
Ainsi, la production de nickel faisant intervenir des solutions acides de chlorure ferrique, la présence d’une installation de traitement d’eau est obligatoire pour éliminer les métaux en solution avant le rejet dans le milieu naturel.
Une neutralisation des effluents étant nécessaire, les rejets de sels sous forme de chlorures ou de sulfates seront importants. De nombreuses techniques de traitement des eaux ont été mise au point et des rejets « zéro » sont parfois atteints.
Généralement, le volume de déchets généré est important. Du fait qu’ils contiennent des métaux, ces déchets sont considérés comme nocifs pour l’environnement et doivent être envoyés en centre d’enfouissement technique ou stockés sur le site dans des bassins ou des alvéoles étanches.
Une partie des déchets peut néanmoins constituer des « matières premières secondaires » directement revendues pour leurs propriétés spécifiques. C’est le cas du CoCl2, du FeCl3 (voir partie sur les coûts).
1 - Economie des procédés d’extraction
liquide/liquide :
Dans la littérature (Techniques de l’ingénieur)[7], on trouve
les données suivantes, relatives au coût des mélangeurs décanteurs :
Coût de
l’équipement pour extracteurs agités mécaniquement
|
Equipement |
Matériau de construction |
Equation donnant le coût (euros) |
Domaine d’application |
|
Mélangeurs-décanteurs |
Acier au carbone |
C=8500(Q/2.2)0.58 |
Q=2.2 à 36L.s-1 |
|
Mélangeurs-décanteurs |
Acier au carbone |
C=12500(Q/10)0.22 |
Q=1 à 10L.s-1 |
|
Mélangeurs-décanteurs |
Acier au carbone |
C=12500(Q/10)0.60 |
Q=10 à 100L.s-1 |
On souhaite traiter un débit de 20m3.h-1, soit 5.55 L.s-1. On en déduit le coût d’un réacteur :
C=8500(5.55/2.2) 0.58=14537.97 euros
Pour une batterie de quatre réacteurs en série, il faut donc prévoir un budget de 58152 euros.
Par ailleurs, les Techniques de l’ingénieur[7] donnent les chiffres suivants :
Coût d’obtention des
différents métaux
|
Métal extrait |
Coût (euros/tonne) |
|
Cobalt-Nickel |
165 |
|
Cuivre |
75 à 260 |
|
Uranium |
2280 |
Dans notre cas (1000 tonnes par mois), il faut donc envisager un budget mensuel de 165000 euros par mois. Cependant, cette estimation peut être diminuée car une grande partie des produits secondaires peut être revendue ce qui a comme conséquence de réduire le coût de production.
2 - Revalorisation des produits
secondaires :
a - le
chlorure de cobalt :
Le
chlorure de cobalt, CoCl2, peut être employé en tant qu’oxyvore. En raison de leur puissantes propriétés réductrices, les oxyvores sont indispensables pour le dégazage chimique de
l'oxygène dissous. Il existe différents types d'oxyvores.
En éliminant l'oxygène, il permettent d'empêcher toute
réaction d'oxydation dans l'eau ou les autres liquides.
D’autre
part, le chlorure de cobalt est employé dans la synthèse de la vitamine B12
(dessinée ci-dessous) qui est
essentielle à l'assimilation des acides aminés. Elle intervient également dans
la synthèse de l'ADN et dans la formation des globules rouges et le
fonctionnement du système nerveux.
Le dichlorure de cobalt peut aussi être utilisé
pour obtenir un isotope artificiel du cobalt, le cobalt 60, qui est très
radioactif, et est utilisé en médecine pour la radiothérapie (cobaltothérapie)
et en radiographie industrielle (fabrication des appareils à rayons X). Il a
une période radioactive de 5,7 années et émet un rayonnement gamma. Ce
rayonnement radioactif est facile à focaliser et permet d'atteindre les tumeurs
profondes sans provoquer trop de lésions en surface. Il est d'autre part moins
coûteux que le radium.
2.2/ Le chlorure ferrique :
Le chlorure ferrique, FeCl3, est l’un des principaux agents de
coagulation utilisé dans l’industrie du traitement des eaux. La coagulation est un procédé qui consiste à ajouter des produits
chimiques à l'eau pour que les particules dissoutes et en suspension
s'agglomèrent en de plus grosses particules qui se déposeront au fond de l'eau
sous forme de boues. La coagulation est une méthode de traitement de l'eau sûre
et efficace, communément utilisée par les municipalités pour le traitement de
l'eau potable. Ce procédé est indiqué pour le traitement de l'eau riche en
matières organiques.
Enfin, ce composé est aussi utilisé
en tant que catalyseur (pour ses propriétés d’acide de Lewis dans l’industrie
chimique.
Conclusion :
Le procédé mis en oeuvre dans l’extraction du nickel utilise des techniques qui sont connues et exploitées dans de nombreux domaines de l’industrie chimique (pharmacie, agroalimentaire,…). Le raffinage du nickel emploie des moyens de production de métaux en voie liquide par solvatation en milieu acide. Les procédés mis en œuvre vont de la mise en solution de métaux (Ni, Fe, Co,…) contenus dans des minerais à la production de nickel pur par électrolyse, en passant par des phases intermédiaires telles que l’extraction par des solvants organiques. La difficulté ne provient pas de la technologie employée en elle même, mais plutôt de la mise en oeuvre. En effet, la diversité des minerais ne permet pas d’utiliser un procédé unique.
Bien que la majeure partie des produits secondaires puisse facilement être revalorisée, l’hydrométallurgie doit également s’impliquer dans la protection de l’environnement. Sur ce plan, les prochaines innovations devront, par exemple, permettre de conserver ou d’améliorer les rendements d’extraction en utilisant des solvants moins nocifs pour l’environnement. En effet, même si le tributylphosphate et la triisooctylamine sont recyclés dans ce procédé, il est impossible d’éviter le rejet contrôlé de certains polluants (vapeurs de TBP de l’ordre de quelques dizaines de p.p.m. ou poussières de minerais…).
Sur un plan personnel, ce projet de groupe nous a permis de comprendre les différentes étapes nécessaires à la conception d’une unité de production, de la bibliographie jusqu’au dimensionnement d’une étape du procédé. Une telle démarche peut s’avérer utile pour un ingénieur et nous a paru enrichissante.
Bibliographie
[1] J-L VIGNES, G. ANDRE ,
F. KAPALA. Données sur les principaux produits chimiques Métaux et
Matériaux. 7 ème édition : Centre de ressources
pédagogiques en chimie. 1997-1998. 458p
[2] CNUCED INFO COMM. Infocomm : Information de marché
dans le secteur des produits de base [en ligne]. Disponible sur http://r0.unctad.org/infocomm/francais/nickel/descript.htm
. (01/05/05)
[3] SOCIETE
ERAMET. Métallurgie du nickel (M2250). Techniques de l’ingénieur, traité
Matériaux métalliques. 04/1996, 22p
[4] Louis
LACOURCELLE. Nickelage chimique (M1565). Techniques
de l’ingénieur, traité Matériaux métalliques . 07/1995. 13p
[5] ERAMET. Présentation de la branche
nickel [en ligne]. Disponible sur http://www.e
http://eramet.fr/fr/nickel/hp_nickel.php. (01/05/05)
[6]
ECOLE CENTRALE
PARIS. Le
site des études [en ligne]. Disponible sur http://www.etudes.ecp.fr/. (01/05/05)
[7] Jean LEYBROS Extraction liquide liquide
- Description des appareils (J2764) –Modélisation des
colonnes ( J2765)- Choix, calcul et conception des appareils (J2766) Techniques de
l’ingénieur, 03/2004
[8] LAURENT RIZET, PIERRE EMMANUEL CHARPENTIER.
Métallurgie extractive. Hydrométallurgie (M2235). Techniques de l’ingénieur,
traité Matériaux métalliques. 09/2000 .13 p
[9] Jacques
VANDEGANS, Anne-Marie de KERSABIEC et Michel HOENIG . Spectrométrie
d'absorption atomique. Techniques
de l’Ingénieur, P2825, 1997
[10] ISO 8466 : qualité de l’eau.
Etalonnage et évaluation des méthodes d’analyse et estimation des caractères de
performance
[11] Norme XP T90-210 : protocole d’évaluation d’une
méthode alternative d’analyse physico-chimique quantitative par rapport à une
méthode de référence , déc
1999
[12] INRS. Sécurité et santé au travail. [en ligne]. Disponible sur http://www.inrs.fr/dossiers/fichtox/somft.htm . Fiches : 68 :
Nickel et composés minéraux ; 154 : Trichlorure
de fer et solutions aqueuses ; 231 : phosphate de tributyle.
