

Les OGM :
Notions importantes en biologie :
introduction
Un Organisme
Génétiquement Modifié (OGM) est un organisme (une plante, un animal, une
bactérie, un virus) dans lequel on a introduit artificiellement un ou plusieurs
gènes, soit inconnus de l'espèce à laquelle appartient cet organisme, soit
appartenant à l'espèce mais ayant subi plusieurs manipulations génétiques.
L'introduction de ces gènes conduit à la production de protéines qui confèrent
de nouveaux caractères à l'organisme génétiquement modifié.
L’intérêt des OGM
réside dans les propriétés que nous pouvons leur apporter et qui visent à
améliorer par exemple la culture d’une plante, ou ses qualités nutritives. Les
gènes les plus souvent retrouvés chez les OGM sont généralement de résistance à
un antibiotique, à un désherbant ou à une toxine.
L’histoire des OGM a commencé il y a moins de trente ans avec la
première bactérie transformée en 1973. Le premier végétal génétiquement
modifié, ou transgénique, est apparu en 1983. Ils représentent aujourd’hui un
véritable débat de société. En effet, si les avantages des OGM sont nettement
mesurables, les risques liés à leur consommation sont encore peu connus par la
population. Or, une très forte croissance de ces derniers est prévue d’ici à
2006. Et ce sont de plus en plus les caractéristiques nutritives des plantes
qui seront modifiées (par exemple l’augmentation de vitamine A dans le riz). Il
est donc important de s’interroger sur notre consommation d’OGM et de mettre en
place des dispositifs de sécurité, de détection, tant que nous ne connaîtrons
pas leurs véritables conséquences sur l’Homme et son environnement.
Ainsi après avoir décrit les techniques d’obtention d’organismes
génétiquement modifiés, puis les moyens de détection utilisés pour des produits
de consommation courante, nous analyserons les avantages et les risques liés à
la fabrication et à la consommation d’OGM.
La cellule étant la plus petite unité du
vivant. Tout organisme se compose d’une ou plusieurs cellules, ce nombre
pouvant atteindre plusieurs milliards. Cependant, selon les organismes, les
cellules peuvent présenter certaines différences dans leur structure. En effet,
la cellule végétale se distingue de la cellule animale notamment grâce à sa
paroi cellulaire, mais les éléments principaux, tels que le noyau
et la membrane plasmique, se retrouvent dans les deux types de cellules, comme
le montrent les schémas suivants.
![]() La cellule
végétale :
La cellule
végétale :
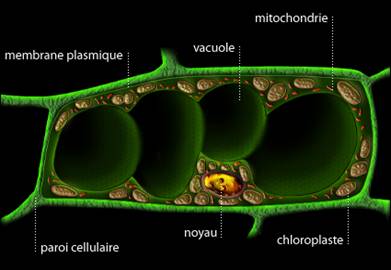
Schéma d'une cellule
végétale
![]() La cellule animale :
La cellule animale :
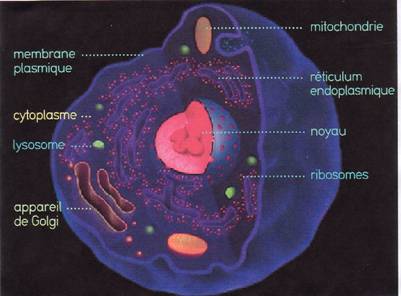
Schéma d'une cellule
animale
2 – Le protoplaste :
La paroi cellulaire donne sa forme et sa rigidité à la cellule végétale.
Si on ôte cette membrane de la cellule, il ne lui reste alors que la membrane
plasmique, qui renferme le cytoplasme, la vacuole et le noyau. Cette cellule
est maintenant un protoplaste. Celui-ci prend une forme sphérique, il pourra
retrouver sa forme d’origine en reformant une nouvelle paroi.
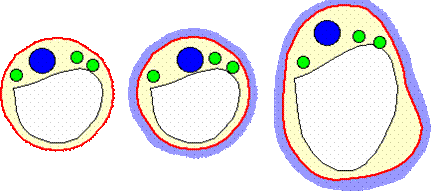
Schéma du passage d'un protoplaste (à gauche) à une cellule (à droite)
3 –
L’Acide désoxyribonucléique :
L’Acide désoxyribonucléique, plus communément appelé ADN, est une
macromolécule présente dans les cellules
de tous les êtres vivants. Quand les cellules se divisent, cet ADN se reproduit
à l'identique : toutes les cellules d'un individu contiennent le même ADN et
celui-ci est spécifique à l’individu concerné, ce qui explique l’unicité des
êtres vivants.
Chez les animaux et les végétaux, l'ADN se trouve dans le noyau
des cellules. C'est lui qui contient toute l'information nécessaire au bon
fonctionnement de la cellule. L'ADN est formé de deux brins enroulés en hélice.
Chaque brin est constitué d’un enchaînement de
nucléotides qui diffèrent par une de leurs molécules,
que l’on appelle « bases
». Il existe quatre bases différentes : adénine (A), thymine (T), guanine
(G) et cytosine (C). Elles maintiennent ensemble les deux brins de l’ADN (A
d’un brin "s’associe" toujours avec T sur l’autre brin, et C toujours
avec G).
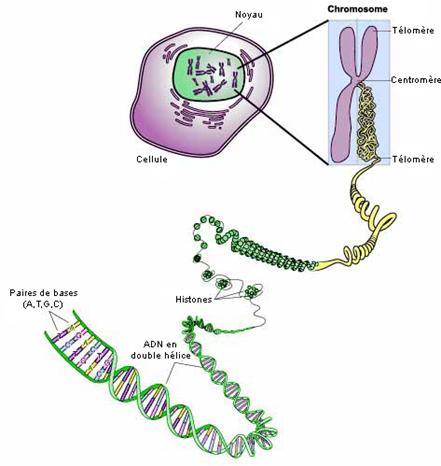
La localisation de
l’ADN
4 – Le
gène :
Un gène est un « morceau » de l’ ADN
contenu dans le noyau de nos cellules
et qui porte le plan de fabrication d’une protéine.
Les gènes sont porteurs des informations relatives aux caractéristiques d’un
individu (la couleur des yeux par exemple). L'homme possède environ 30000
gènes. Certaines espèces animales et végétales ont plus de gènes que l'homme.
Maintenant
que nous avons défini les éléments qui sont manipulés lors de la fabrication
d’un OGM, nous allons pouvoir étudier les différentes méthodes inventées par
l’Homme pour obtenir un organisme qui possède un ou plusieurs nouveaux gènes,
conférant à celui-ci des caractéristiques supplémentaires. Ces méthodes sont
classées selon deux types : les techniques de transfert direct et celles
de transfert indirect.
B - Techniques de transfert direct :
La transformation
directe consiste en l'introduction dans l’ADN d'un gène
véhiculé le plus souvent par un plasmide* classique, par le biais de
techniques physico-chimiques.
Il existe plusieurs techniques de transfert direct que
nous allons expliciter : l’électroporation, la micro-injection et la
biolistique.
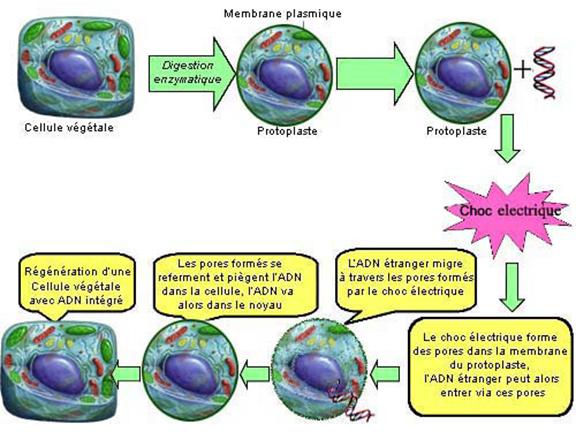
1 – L’électroporation :
L'électroporation
est une des techniques les plus simples à mettre en œuvre. Elle consiste à
soumettre un mélange de protoplastes et d'ADN à des chocs électriques.
Le champ électrique provoque la déstabilisation de la
membrane plasmique du protoplaste et conduit à l'ouverture des pores
membranaires, facilitant ainsi le passage de l'ADN dans le noyau. Or, les
protoplastes baignent dans une solution de plasmides. Ces derniers passent donc très facilement dans la cellule
qui se trouve à son tour génétiquement modifiée.
Cette manipulation est possible car le phénomène
d’ouverture des pores est réversible. En effet, si le choc électrique n'a pas
été trop violent, la membrane peut alors reprendre son état initial.
C’est grâce à cette technique que le riz, le maïs ou
l’orge ont été transformés pour la première fois.
On peut schématiser cette technique
ainsi :
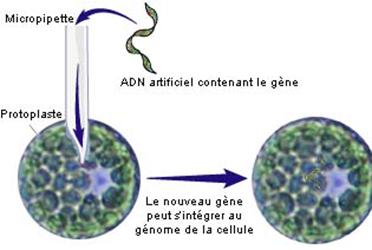
2 – La micro-injection :
La micro-injection se réalise sur des protoplastes, dont nous avons
vu précédemment la formation. L'opération consiste à
introduire directement le gène étranger dans la cellule à modifier, à l'aide
d’un micromanipulateur monté avec un microscope.
On maintient le protoplaste à
transformer avec une micro-aiguille et on introduit le
gène accompagné de son
complexe promoteur-terminateur
(voir ci-dessous) dans le noyau, à l’aide
d’une micro-pipette. La cellule est alors génétiquement modifiée. Après l’injection,
le protoplaste est libéré et mis en culture sur un milieu approprié.
Un promoteur est une séquence d’ADN
placée en amont du gène et qui est nécessaire à sa transcription, c'est-à-dire
à la formation d'un messager : l'ARN (Acide RiboNucléique), ce dernier étant
une copie d'un brin de l'ADN qui est capable de
sortir du noyau. Un terminateur est une séquence d’ADN présente en aval du gène
et au niveau de laquelle l'élongation de l'ARN prend fin (fin de la
transcription).
 Cependant
cette méthode ne s'applique que dans des cas particuliers car elle est complexe
et lourde à utiliser : pour réussir l'opération, il faut injecter mille copies
du gène dans l'espoir qu'une cellule puisse accepter cet ADN étranger.
Cependant
cette méthode ne s'applique que dans des cas particuliers car elle est complexe
et lourde à utiliser : pour réussir l'opération, il faut injecter mille copies
du gène dans l'espoir qu'une cellule puisse accepter cet ADN étranger.

Schéma récapitulatif de
la micro-injection
Micromanipulateur
monté avec un microscope.
3 – La
biolistique :
La biolistique, ou balistique biologique, est la méthode la plus
courante. Elle consiste à propulser le transgène* dans les cellules végétales.
On utilise des microbilles de métal
enrobées d’ADN (billes d’or ou de tungstène de un micron). Elles sont projetées
à grande vitesse sur les cellules à transformer afin de traverser leur paroi.
Ces billes seront progressivement freinées en traversant les différentes
couches cellulaires. Quelques-unes des cellules atteintes vont alors insérer
spontanément les transgènes dans leur génome. Mais le noyau de la cellule intègre l'ADN de façon aléatoire. Il faudra environ quinze jours pour s'assurer que les nouveaux gènes
introduit se sont bien intégrés au génome.
Cette méthode est très prometteuse, car elle permet de
façon simple et rapide d'injecter de l'ADN dans une grande quantité de cellules
sans passer par une phase protoplasmique,
encore très mal maîtrisée chez certaines espèces. De plus, cette injection peut
être réalisée sur un tissu non désolidarisé de l'organe d'origine.
Il
existe également d’autres procédés pour fabriquer un OGM : les techniques
de transfert indirect. Celles-ci utilisent l’intermédiaire de bactéries qui
véhiculent le transgène jusqu’à la cellule souhaitée. Nous allons voir comment
ces méthodes sont mises en action concrètement.
C - Techniques de transfert indirect :
Le développement
de la transgénèse végétale a connu son essor grâce à la découverte de bactéries
telluriques* phytopathogènes : Agrobacterium tumefaciens et Agrobacterium
rhizogenes.
1 – La transfection
biologique :
La méthode de la
transfection biologique utilise les propriétés de ces bactéries. C’est une
méthode plus « naturelle » que celles que nous avons vues
précédemment.
![]() Première
étape :
Première
étape :
Tout d’abord, on
introduit le gène d’intérêt dans un plasmide. Pour cela, on utilise différentes
enzymes, notamment une enzyme de restriction et la ligase.
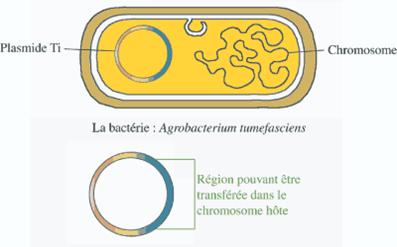
Schéma d'un plasmide
dans une bactérie
On obtient donc un plasmide génétiquement modifié comprenant le gène
d’intérêt.
![]() Deuxième
étape :
Deuxième
étape :
Dans un second temps, ce plasmide est transféré dans une bactérie,
généralement de l’espèce Escherichia coli (E. coli). On cultive les colonies de
E. coli transformées pour préparer le plasmide vecteur.
![]() Troisième
étape :
Troisième
étape :
L’étape suivante a pour but de sélectionner les bactéries E. coli qui ont été transformées. Les bactéries ayant intégré le plasmide possèdent maintenant le gène d’intérêt, mais également un gène de résistance à un antibiotique particulier. Les bactéries sont donc placées dans un milieu de culture qui contient cet antibiotique. Les bactéries transformées génétiquement seront les seules à se développer dans ce milieu, c’est ainsi qu’elles sont sélectionnées.
![]() Quatrième étape :
Quatrième étape :
On intègre alors le plasmide transformé dans une plante à l’aide d’une autre bactérie : Agrobacterium tumefaciens (A. tumefaciens), qui possède la capacité à introduire des fragments précis de son ADN dans le génome des plantes. Le plasmide est transféré de E. coli à A. tumefaciens par choc thermique ou par conjugaison (voir schéma ci-dessous).

Schéma de la conjugaison
![]() Cinquième
étape :
Cinquième
étape :
Enfin, on place dans un milieu de culture commun des bactéries A. tumefaciens et un fragment de tissu végétal (un morceau de feuille ou de tige par exemple). Grâce aux propriétés de la bactérie, la partie du plasmide qui contient le gène d’intérêt est transférée dans le noyau de la cellule végétale qui l’intègre alors dans son génome.
La dernière étape est alors la régénération de plantes entières à partir de ces cellules.
Malheureusement, cette méthode plus « naturelle » ne fonctionne que chez certaines espèces (tabac, colza, tomate, pomme de terre melon et tournesol).
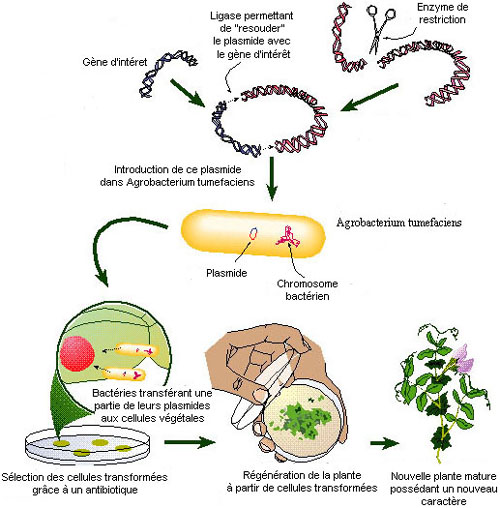
Schéma récapitulatif des différentes étapes de la transfection biologique
2
– La lipotransfection :
La technique de la lipotransfection est également une méthode dite directe. Le but de cette méthode est d’ « emprisonner » le gène d’intérêt dans un liposome, c’est-à-dire une structure sphérique constituée de lipides. Ceux-ci ont la capacité de fusionner avec la membrane de protoplastes, ils libèrent ainsi leur contenu (ici le gène d’intérêt) dans le cytoplasme du protoplaste. Cependant, seulement une minorité de ces gènes pourront parvenir jusqu’au noyau et s’intégrer par la suite au génome de la cellule, c’est pourquoi cette méthode est peu utilisée.
Conclusion :
Il existe donc diverses méthodes de fabrication d’un OGM, basées sur des principes différents. Ces techniques fonctionnent toutes sur des cellules végétales. Cependant les cellules animales sont spécifiques, elles ont un rôle déterminé au sein de l’organisme, ainsi, pour créer un OGM animal, il faut agir sur la cellule à la base de toutes les autres : la cellule-œuf (qui donnera alors naissance à un nouvel organisme génétiquement modifié). On utilise donc plus particulièrement la technique de la micro-injection en ce qui concerne la transgenèse animale.
Une fois l’organisme modifié, il est nécessaire de pouvoir vérifier que l’opération de transgenèse a correctement fonctionné, c’est pourquoi les chercheurs ont mis en place des méthodes de détection des OGM. De plus, cette détection est nécessaire pour informer les consommateurs sur la véritable nature de leurs aliments : génétiquement modifiés ou non.
II -
Comment détecter les OGM ?
La détection des
OGM dans les aliments humains est une obligation réglementaire (directive
européenne) depuis septembre 1998. La réglementation retient les protéines et
ADN issus des OGM comme critère de détection. Il n'existe pas actuellement de
méthode normalisée de détection des OGM. Les méthodes de détection utilisent le
plus souvent la réaction de polymérisation en chaîne (PCR), qui permet de
détecter n'importe quel fragment d'ADN dont on connaît la séquence.
A
- La réaction de polymérisation en chaîne :
1 – Principe :
La réaction de polymérisation
en chaîne, ou PCR, est une méthode pour copier des milliers de fois des brins
d'ADN en l'espace de quelques minutes, en utilisant les capacités naturelles
d'une enzyme appelée la polymérase. La réaction de polymérisation en chaîne
facilite le travail des scientifiques qui étudient un certain morceau d'ADN,
qui aurait pu avoir été prélevé à partir d'un échantillon
minuscule de liquide organique en grossissant sa présence. De cette manière, à
partir d'un tout petit nombre de molécules, il est possible de produire un
grand nombre de copies du gène cible.
Imaginée par M. Mullis en 1985
(Prix Nobel en 1993), la technique connu un essor considérable à partir de la
commercialisation, vers 1988, d'une ADN polymérase résistante aux températures
élevées : la Taq polymérase, qui permit une automatisation de la
technique.
Puisque les séquences d'ADN
sont spécifiques à une espèce ainsi qu'aux individus dans cette espèce, la
réaction de polymérisation en chaîne peut être utilisée pour identifier
l'espèce et l'individu exact à partir d'une d'un seul morceau d'ADN.
Avant de débuter la PCR, une région cible
de l'ADN est choisie. La séquence
de nucléotides
de cette région ne doit pas nécessairement être connue, à l'exception de deux
courtes séquences situées à chaque extrémité. Des
copies complémentaires des séquences sont créées en utilisant des enzymes
spéciales : les « amorces ». Elles identifient le début et la fin du
processus de copie. Par exemple, si l’on veut copier un brin d'ADN qui est long
de 20 nucléotides mais que l’on ne désire que la séquence entre les numéros 3
et 7 ; les séquences des nucléotides jusqu'au 3 et après le 7 sont
identifiées et ensuite deux segments complémentaires de ces séquences, les
amorces, sont formés avant que la réaction de polymérisation en chaîne ne
commence.
2 - Les trois étapes de la PCR :
Pour accomplir cette réaction,
quatre choses sont donc nécessaires : le fragment d'ADN à copier, deux
fragments amorces (fragments d’ADN spécifiques du gène recherché), l'enzyme de la polymérase et une machine spéciale qui
contrôle parfaitement la température.
![]() La dénaturation :
La dénaturation :
 Tout
d'abord l'ADN choisi, initialement sous forme de double hélice, est séparé en
un seul brin d'ADN. Cette étape est nécessaire parce qu'un morceau d'ADN ne
peut pas être copié lorsqu'il est sous forme de double hélice. Le procédé de
séparation s'appelle la «dénaturation». Celle-ci se produit lorsque l'ADN est chauffé
à 90-96°C.
Tout
d'abord l'ADN choisi, initialement sous forme de double hélice, est séparé en
un seul brin d'ADN. Cette étape est nécessaire parce qu'un morceau d'ADN ne
peut pas être copié lorsqu'il est sous forme de double hélice. Le procédé de
séparation s'appelle la «dénaturation». Celle-ci se produit lorsque l'ADN est chauffé
à 90-96°C.
Schéma d’un morceau d’ADN
![]() Les amorces :
Les amorces :
La prochaine étape est
d'ajouter des amorces et de baisser la température pour faciliter leur collage.
Puisque les amorces sont complémentaires aux zones du début et de la fin de la
partie choisie de la séquence d'ADN, elles se colleront sur ces dernières et
agiront comme des éléments constitutifs de l’ADN pour que le processus de
copiage commence et s'arrête.
![]() L’élongation :
L’élongation :
Ensuite, la polymérase (enzyme
de copiage) est ajoutée et la température est légèrement augmentée pour qu'elle
soit idéale au bon fonctionnement de l’enzyme. Elle identifie alors les amorces
et commence à copier.
Le cycle entier est répété à
plusieurs reprises jusqu'à l’obtention de millions de brins d'ADN. La copie
d’un cycle prend environ une à trois minutes. Étant donné qu'à chaque cycle, le
nombre de molécules est doublé, le nombre de molécules d'ADN après n cycles est
de 2n. L'ordre de grandeur à retenir est
celui du million de copies en quelques heures.
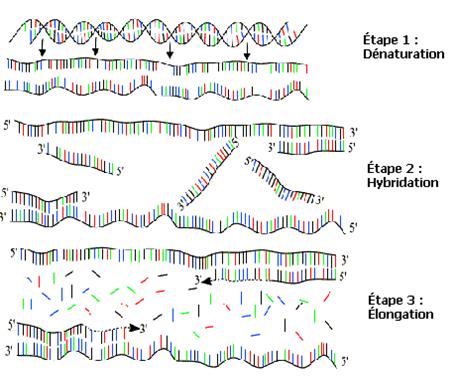
Les trois étapes de la PCR
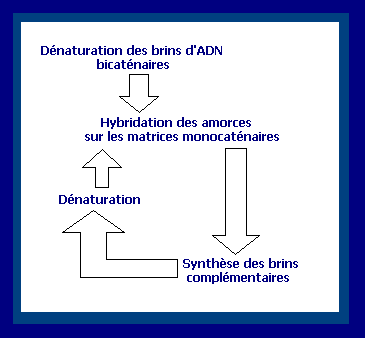
Le cycle de la
polymérisation en chaîne
3 -
Les deux types d’analyse que permet la PCR :
La PCR est une technique permettant de
détecter la présence d’OGM mais aussi l’identification d’un gène transgénique.
![]() La
détection :
La
détection :
Pour déceler la présence d’ADN génétiquement modifié, on a recours à des amorces non spécifiques mais présentes dans la plupart des constructions génétiques. En effet, certains OGM sont construits selon les mêmes modèles. Cela signifie que l’on retrouve des régions communes à plusieurs OGM (promoteurs, gènes de résistance, gènes de visualisation, etc.). Il s’agit simplement de détecter l’un de ces motifs pour pouvoir affirmer la présence d’OGM. Cependant on ne sait pas quel type d’OGM est alors impliqué.
Par contre, s’il
n’y a pas de détection, il est impossible de conclure à l’absence de ce type
d’ADN. En effet, l’OGM peut avoir été construit avec un autre promoteur et un
autre terminateur que ceux que l’on a cherché à détecter. De plus certains
végétaux, appelés « faux positifs », ont la particularité d’être
toujours reconnus positifs par le test.
La deuxième stratégie permettant
d’identifier un ADN d’origine OGM nécessite cette fois-ci des amorces
spécifiques à chacune des constitutions génétiques possibles et connues.
L’inconvénient de cette technique est qu’elle implique de savoir exactement ce
que l’on recherche, il faut alors utiliser des banques de gènes et des
logiciels spécifiques pour déterminer les amorces à utiliser.
4 -
Conclusion :
Le principal défaut de ces deux techniques
est également leur avantage. Elles sont capables de détecter des OGM pour des
niveaux de un millième à dix millionièmes. Or ce seuil de sensibilité très
faible rend difficile la quantification précise du taux en OGM d'un aliment. Si
un test quantitatif est nécessaire, la technique de PCR peut également être
utilisée, mais dans des conditions particulières qui demandent une mise au
point spécifique. La PCR est donc une technique essentiellement qualitative.
D’autre part, l’introduction des amorces implique que l’on ne peut détecter que
des gènes que l’on connaît déjà.
Nous n’allons pas traiter le cas de la
méthode PCR quantitative car il existe une autre technique, bien plus simple,
de quantification du taux en OGM.
B - La détection au
niveau des protéines :
1 –
Principe :
Il est possible de détecter la présence de protéines résultant de l’introduction d’ADN étranger. Les méthodes reposant sur la détection des protéines conviennent surtout aux produits bruts ou peu transformés comme les grains de maïs ou de soja, car les procédés industriels (chauffage, traitements chimiques…) altèrent les protéines et les rendent indétectables. De plus la localisation de la protéine ne doit pas rendre l’opération trop difficile. Cette technique présente l'avantage de permettre facilement la quantification des OGM.
Il s’agit de tests
immunologiques de type ELISA (Enzyme Linked ImmunoSorban Assay) par
exemple. Ils permettent de détecter une protéine codée par un gène introduit
dans une plante. Les principaux avantages de ces tests sont que ceux-ci sont rapides
(effectués en moins de deux heures) et peu coûteux (environ 1,50€).
|
|
||||
|
|
||||
|
|
||||
1ère colonne : plante sauvage |
||||
|
2ème
colonne : plante transgénique |
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
||||
|
|
Mise en évidence d’un OGM
Pour des plantes de
la même espèce, on distingue bien la présence d’un gène commun (situé en haut)
et surtout le gène transgénique introduit dans la plante de droite.
2 – Expérience :
On peut réaliser la
même expérience avec une plante transgénique et une plante naturelle. Après
avoir extrait les protéines de la plante, on les met en présence d’un anticorps
spécifique de la protéine codée par un gène transgénique. Cela signifie que cet
anticorps ne peut se fixer qu’à la protéine codée par le gène transgénique.
Deux cas peuvent alors se présenter.
- Une protéine se
fixe à l’anticorps. Elle correspond donc à la protéine que l’on recherche. Un
gène a donc été introduit artificiellement dans la plante et a codé cette
protéine.
- Aucune des
protéines ne se fixe à l’anticorps. Le type de protéine que l’on recherche,
spécifique à l’anticorps introduit, ne se trouve donc pas dans la plante.
Pour visualiser les
résultats de l’expérience, on effectue par la suite un lavage, c’est-à-dire que
l’on enlève toutes les protéines qui ne se sont pas fixées à l’anticorps. On
ajoute ensuite un autre anticorps, qui est lui aussi spécifique de la protéine
recherchée et fluorescent. Ceci nous permet de le repérer facilement.
On procède ensuite
à un nouveau lavage. Si une protéine est fixée sur l’anticorps, le deuxième
anticorps fluorescent peut alors se fixer sur l’autre côté de la protéine. Le
test est ainsi positif (1er cas). Si au contraire aucune protéine ne correspond
au premier anticorps, l’anticorps fluorescent ne se fixe pas. Le test est
négatif (2ème cas).
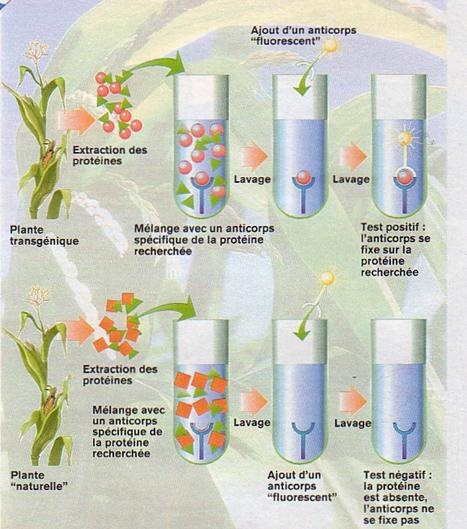
Schéma de la détection au niveau des protéines
3 – Conclusion :
Cette dernière
technique présente l'avantage de permettre facilement la quantification des
OGM. Cependant, elle convient surtout aux produits bruts ou peu transformés.
Pour cette raison, les méthodes basées sur la détection de l’ADN (par PCR) sont
actuellement privilégiées en Europe.
C
- La puce à ADN, une clé pour l’avenir :
Aujourd’hui une
nouvelle perspective se développe : la puce à ADN. Celle-ci est le
résultat du développement simultané de la microélectronique, l’informatique, la
chimie et la biochimie moléculaire. Ces puces sont d’ailleurs déjà utilisées
dans le domaine médical.
Des séquences d’ADN
greffées sur une puce constituent des sondes constituent des sondes dont le
rôle est de détecter les cibles, c’est-à-dire les séquences qui leur sont
complémentaires.
Ces puces à ADN
représentent un grand progrès en matière de détection des OGM. En effet, elles
permettent un important gain de temps et sont moins coûteuses que les autres
méthodes.
III – Les risques et
les avantages des OGM :
Quels sont les enjeux de la technologie transgénique?
Pourquoi est-elle aussi controversée? Pourquoi suscite-t-elle autant débats?
Comment démêler le vrai du faux? Nous avons tenté de faire un tour d’horizon
rapide pour donner une vision globale de la problématique et ainsi arriver à se
faire une opinion éclairée.
A - Les
risques :
A l’heure actuelle, alors que la Commission Européenne a levé un moratoire de cinq ans sur
les autorisations de nouveaux OGM, le consommateur européen reste
majoritairement opposé à leur introduction.
En effet, les OGM peuvent induire différentes maladies qui peuvent
toucher aussi bien les animaux que l’environnement dans lequel il évolue.
1- Les
OGM et la santé
![]() Les allergies :
Les allergies :
Tout OGM est potentiellement
allergisant car il n'est pas reconnu par l'organisme qui le reçoit, que ce soit
par voie digestive ou par voie aérienne. Les expériences ont montré le pouvoir
allergisant du « soja à la noix » : la noix de Brésil est un aliment
reconnu pour provoquer des allergies chez certains individus. Par conséquent, on
a dû soumettre le soja OGM qui a été créé à partir d’un des gènes de la noix à
une multitude de tests pour vérifier si la protéine produite par ce gène avait
conservé son pouvoir allergène. Pour le savoir, les chercheurs ont mis en
contact la dite protéine avec du sérum de patients connus pour être
allergiques. On observa une réaction immunitaire immédiate. Pour cette raison,
ce nouveau soja n’a pas été commercialisé, même s’il avait été développé pour
l’alimentation animale mais qu'en sera-t-il pour les fraises, tomates, et
autres bananes transgéniques ?
![]() Les intoxications :
Les intoxications :
Aucune
preuve expérimentale n'a permis d'éliminer les risques potentiels des molécules
insecticides fabriquées par les plantes transgéniques. Ces substances peuvent
être toxiques pour le foie, les reins, le cerveau. De même les aliments
fabriqués à partir des végétaux qui tolèrent les herbicides peuvent devenir
toxiques en raison de leur forte teneur en poisons. Ces derniers peuvent aussi
se retrouver dans toute la chaîne alimentaire (lait, viande) jusqu’à des doses
maximales autorisées.
![]() Les maladies auto-immunes :
Les maladies auto-immunes :
Certaines
maladies auto-immunes sont secondaires à l'apparition de complexes immuns
circulants formés de substances étrangères fixant des anticorps spécifiques
développés contre ces substances extérieures. Les
nouveaux aliments OGM, leurs virus, ne peuvent-ils pas passer la barrière
digestive et ne peuvent-ils pas créer des phénomènes identiques? S'il n'en est
pas ainsi pour les aliments habituels que l’Homme a connus peu à peu dans son
évolution millénaire, c'est parce que nous avons appris à créer des enzymes
adaptées à les disséquer dans notre tube digestif avec l'aide du pancréas
notamment. Ces enzymes ont été acquises peu à peu, au cours de l'évolution, et
notre corps sait les fabriquer, au jour le jour, en fonction des aliments
ingérés. Encore faut-il que l'organisme ait eu un jour connaissance de ces
aliments. Il est donc fort probable que le corps mette un certain temps avant
d'apprendre à dégrader les brins d'ADN manipulés. Ce qui renforce conséquemment
les risques de pénétration digestive, d'allergies et de maladies auto-immunes.
![]() Les résistances aux antibiotiques :
Les résistances aux antibiotiques :
Comme nous l’avons vu précédemment, les
chercheurs intègrent souvent un gène de résistance à un antibiotique en même
temps que le transgène à la cellule qu’ils veulent modifier.
Le développement de la résistance aux
antibiotiques doit être envisagé comme une
fatalité. En effet, si la recrudescence de micro-organismes pathogènes due au
développement de résistances aux antibiotiques est réelle, nous pouvons espérer
une parade grâce aux progrès incessants de la biologie moléculaire, qui ne se
contentera bientôt plus de produire en masse des substances antibiotiques
naturelles, mais qui sera capable d'inventer de nouvelles molécules entièrement
synthétiques. A l'exemple de la bataille à laquelle se sont livrées les espèces
au cours de l'évolution, nous ne pouvons pas rester sur des acquis mais devons
toujours développer de nouvelles stratégies pour contrer celles de
l'adversaire.
2 - Les OGM et
l'environnement :
![]() Les mutations génétiques :
Les mutations génétiques :
Les plantes
génétiquement modifiées pour s'auto protéger contre un insecte, par exemple,
pourraient susciter l'apparition d'insectes résistants à ces plantes transgéniques,
à la suite d'une mutation génétique « naturelle » chez ces derniers.
Il existe des indices de probabilité de
réalisation de ce risque, qui ne découlent pourtant pas des plantes
génétiquement modifiées, mais bien des méthodes utilisées classiquement en
agriculture. En effet, une toxine produite par la bactérie Bacillus
thuringiensis, est utilisée dans différents pays, dont la France, notamment en
agriculture biologique, sous forme de bio-pesticide (mélange de bactéries
pulvériséés). Il y a donc de nombreuses toxines dans cette pulvérisation. On en
connaît actuellement plus de 250.
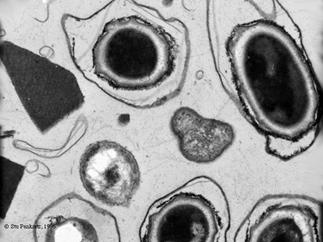
Le bacille Thuringiensis est une bactérie à tiges génératrices de spores.
Pendant la production de spores, des corps cristallins sont formés. Le bacille
a une structure en cristal comme le triangle à gauche sur cette image. Les
cristaux se dissolvent dans l'intestin de l'insecte affecté et paralysent les
cellules épithéliales. L'insecte cesse alors de manger et meurt par la suite
pendant que le bacille développe des spores et se reproduit dans le sang de
celui-ci. Ce bacille affecte plus de 150 insectes.
Bacilles thuringiensis dans la cytoplasme
Or, dans certains pays (Malaisie,
Japon, Hawaï), son application répétée, sous forme de pesticide, a entraîné la
sélection de populations d’insectes ravageurs capables de résister à l'action
de ce produit.
![]() Les effets non désirés :
Les effets non désirés :
Les Plantes Génétiquement Modifiées (PGM)
en vue de leur donner une résistance naturelle à un insecte peuvent affecter
des insectes non visés par la modification de la plante. C'est le cas par
exemple pour les abeilles et le monarque qui, bien que non indésirables, sont
éliminés par certaines plantes génétiquement modifiées.
En effet, il a été mené en 1999 une
expérience sur le monarque, papillon d'Amérique du Nord réputé pour sa beauté.
Des chenilles de ce papillon ont été nourries avec des feuilles
artificiellement recouvertes de pollen d'une variété de maïs génétiquement
modifié par l'introduction d'un gène commandant la production d'un insecticide
contre la Pyrale. Ces chenilles ont connu une croissance plus lente et une
mortalité plus élevée que d'autres nourries de feuilles recouvertes de pollen
de maïs classique. L'expérience a donc démontré le « danger » encouru par le
papillon.
- Aspect du maïs
transgénique et non transgénique, infesté par la larve de Pyrale :

Cet épi de maïs a été obtenu sur un plant normal, non
transgénique, infesté par la chenille de la Pyrale.
Epi
de maïs non transgénique

Cet autre épi de maïs provient d'un plant transgénique,
infesté par la chenille de la Pyrale. On remarque bien sur cette photo que le
maïs est de bonne qualité, c’est-à-dire que l’insecticide empêche la Pyrale de
l’attaquer.
Epi de maïs transgénique

Les chenilles ayant consommé des épis issus de plants de
maïs non transgéniques se développent, se transforment en chrysalides puis en
adultes capables de se reproduire.
Chenille ayant consommé du maïs non transgénique
Celles s’étant nourries avec le maïs transgénique présentent une paralysie du système digestif, cessent de s'alimenter et
meurent rapidement.
présentent une paralysie du système digestif, cessent de s'alimenter et
meurent rapidement.
Chenille ayant consommé du maïs transgénique
- L'éventuel impact sur les insectes
« non cibles » :
Des insectes utiles comme les abeilles, risquent d'être
affectés par le développement des plantes transgéniques. On parle alors d'effet
sur les insectes « non cibles », c'est-à-dire sur ceux qui ne sont
pas visés par la modification génétique, mais sur qui la plante transgénique
pourrait néanmoins influer le changement de métabolisme de la plante. Des
études portant sur des colzas résistants à un herbicide sont menées à
l'Institut Nationale de la Recherche Agronomique (INRA) depuis 1990 et n'ont
pas permis de mettre en évidence, pour l'instant, des effets sur la mortalité
des abeilles, ni sur leur comportement de butinage. Toutefois, même s'il n'est
pas encore apparu clairement, surtout en comparaison avec les effets actuels
des insecticides, ce risque ne peut être écarté.
Il est donc nécessaire de procéder à
l'analyse des sécrétions des plantes transgéniques mellifères (par exemple le
colza), ainsi qu’à l'évaluation de l'incidence d'une exposition à des plantes
transgéniques.
On pourrait se dire que, devant autant de problèmes réels ou
potentiels, il serait plus raisonnable de bannir les OGM. Ce serait pourtant
faire l'impasse sur de nombreux avantages.
Quels
sont les avantages des produits génétiquement modifiés pour la santé des
consommateurs ?
![]() Des fruits, légumes et féculents améliorés sur le plan
gustatif :
Des fruits, légumes et féculents améliorés sur le plan
gustatif :
Les
biotechnologies contribuent à l'amélioration des qualités gustatives des
aliments. L'objectif est de fournir à des consommateurs éloignés des lieux de
production des produits aux arômes développés.
 Des
tomates, des melons, des bananes à
maturation retardée plus
savoureuses.
Des
tomates, des melons, des bananes à
maturation retardée plus
savoureuses.
Par transgénèse, on introduit
un gène permettant de différer le ramollissement qui accompagne le mûrissement.
Ainsi, ils se conservent
mieux, sont plus savoureux et contiennent plus de vitamines car ils peuvent
être récoltées à un stade de maturation avancée.
![]() Des aliments plus diététiques et respectueux de notre santé
:
Des aliments plus diététiques et respectueux de notre santé
:
Les biotechnologies sont également fortement porteuses
d'espoirs dans le domaine de l'amélioration de la qualité nutritionnelle des
aliments.
- Des
plantes produisant des sucres et aliments « zéro calorie » :
De nombreux consommateurs
recherchent ces sucres afin de réduire leur ration journalière de calories
apportées par l'alimentation. Ainsi, par transfert de gène, on fait produire à
des betteraves un type de sucre comestible mais n’apportant aucune calorie. On
peut aussi améliorer la qualité gustative de fruits ou de légumes par
l'introduction d'un gène produisant une protéine naturelle sucrée (la
brazzéine) sans apporter la moindre calorie.
- Des
plantes enrichies au bêta carotène :
Aujourd'hui, un milliard de
personnes souffrent de carence en vitamine A (notamment en Afrique, en Asie).
Or, la vitamine A, fournie par le bêta carotène, est un élément nutritif
essentiel pour la vue et la croissance. Par ailleurs, cet antioxydant naturel
constituerait également un élément de prévention du cancer et des maladies
cardiaques. Les gènes du bêta carotène peuvent être introduits dans les
tomates, le riz et le colza, augmentant ainsi leur qualité nutritionnelle.
- Des
plantes enrichies en fer :
Selon l'Unicef, la carence en
fer concernerait presque 3,7 milliards de personnes aujourd’hui dans le monde,
dont la majorité sont les femmes et les enfants de moins de cinq ans dans les pays
en voie de développement.
Ici aussi, les OGM pourrait
apporter un progrès. En effet, des travaux ont permis de doubler le contenu en
fer du riz en y introduisant le gène de la ferritine.
- Des
huiles riches en acides gras spécifiques :
Des recherches sont en cours
sur la réduction de la teneur en acide gras mono-insaturés (graisses animales)
contenues dans les huiles afin de limiter les risques cardio-vasculaires. Il
s'agit d'introduire des gènes de désaturases dans les plantes oléagineuses
comme le colza et le soja pour augmenter les proportions d'acides gras saturés.
Ces acides gras sont les « bonnes graisses » indispensables à notre organisme.
-
La réduction des toxiques dans certains aliments :
Enfin, de nombreuses études
ont montré qu’il est possible de réduire, voire éliminer, les protéines
allergisantes des céréales comme le riz et le soja. En Asie, nombreux sont les
consommateurs qui souffrent d'allergie au riz. Or le riz constitue l'aliment de
base de plus de deux milliards de personnes.
![]() Des plantes produisant des médicaments, les
« alicaments » :
Des plantes produisant des médicaments, les
« alicaments » :
Dans le domaine de la
médecine, la modification génétique présente des avantages divers et variés et
pour le moins intéressants.
La solution des plantes
transgéniques pour produire des médicaments est considérée comme une voie
d'avenir sûre, en termes de risques de contamination. En effet, il n'y a pas de
maladies transmissibles entre l'homme et la plante, ce qui n'est pas le cas
entre l'homme et l'animal. Ainsi,
l'équivalent de la lipase gastrique du chien, utilisée dans la lutte contre la
mucoviscidose,
a été produit expérimentalement par des colzas et des maïs transgéniques.
-
Des vaccins sans piqûres :
Désormais, le génie génétique
permet, par la modification du patrimoine génétique de plantes, de leur faire
synthétiser des substances vaccinantes. Il s'agira alors simplement de manger
un aliment pour être vacciné contre une maladie précise.
Cela présente un intérêt,
notamment pour les pays du tiers monde. En effet, les chercheurs prévoient déjà
d'utiliser des bananiers génétiquement modifiés pour produire ces vaccins,
d'une part pour leur fécondité importante, et d'autre part parce que la banane
peut être transportée et stockée sans grandes difficultés, contrairement aux
vaccins actuels.
- Des
animaux transgéniques produisent des médicaments :
Un an après sa naissance, une
truie expérimentale, Génie, a été la première truie du monde à produire dans
son lait, de grandes quantités de protéines C humaine.
De nombreux malades en ont
besoin, comme les personnes hémophiles, qui manquent de protéines C pour
assurer la coagulation du sang. On administre parfois la protéine C aux opérés
à qui l'on remplace une articulation. Or, ces protéines sont en si faibles
concentrations dans le sang des donneurs qu'elles sont difficiles à obtenir et
limitent notablement leur utilisation thérapeutique. La mise au point d'animaux
transgéniques coûte moins cher et permet de fabriquer de grandes quantités de
protéines C humaines. De plus, comme nous l’avons signalé, il n'y a aucun
risque d'infection.
-
Des greffes d'organes d'animaux à l'homme :
Comme tout le monde le sait,
les greffes d'organes sont rares, faute de donneurs, et risquées du fait de la
possibilité importante de rejet. Si on ajoute à cela les problèmes d'incompatibilités
entre le donneur et le receveur, on comprend la difficulté à trouver des organes pour ces interventions. Là
encore, le génie génétique peut apporter des solutions. En effet, en modifiant
le génotype d'animaux par transfert de gènes humains, on peut supprimer le
phénomène de rejet lors de la greffe d'un organe animal à un homme.
Des résultats prometteurs ont
déjà été obtenus sur des porcs transgéniques mais des raisons compréhensibles
d'ordre sanitaire (transmission de virus) et éthique empêchent pour l'instant
les essais cliniques chez l'homme.
-
La production de molécules :
Depuis les années 1970, les
scientifiques savent modifier des micro-organismes en vue de la synthèse de
molécules. Grâce à des micro-organismes conçus sur mesure, il est possible de
produire de l'insuline ou des hormones de croissance, jusque-là extraites de
pancréas de porc ou d'hypophyse humaine (chez des cadavres).
D’autre part, des études sont
en cours sur des plants de tabac qui pourraient synthétiser de la lipase, une
enzyme permettant de combattre la mucoviscidose.
Ainsi, le recours aux
médicaments biologiques présente deux avantages :
Premièrement, sur le plan
économique, la fabrication de médicaments par les « usines biologiques » coûte
moins cher que les méthodes « traditionnelles ».
Ensuite, sur le plan médical, le traitement par des
médicaments provenant de plantes génétiquement modifiées supprime les risques
de transmission d'agents pathogènes des tissus humains ou animaux. En effet,
les virus des plantes ne sont pas transmissibles à l'homme ou tout du moins
n'ont aucun effet sur son organisme.
![]() Une pollution et une exploitation des sols moins importante
:
Une pollution et une exploitation des sols moins importante
:
Quelques plantes
génétiquement modifiées, les PGM, sont capables de synthétiser elles-mêmes un
insecticide. Il n'y aurait alors plus besoin de pulvériser les champs, et donc
le sol, avec des insecticides. Ceci permettrait une baisse de la pollution dans
les régions agricoles.
Pour revenir à l’exemple du
maïs résistant à la Pyrale, il faut savoir que les PGM sont plus efficaces dans
la lutte contre les insectes ravageurs que les insecticides chimiques car celui
synthétisé par la plante est présent en permanence. Ainsi, les insectes cibles
sont touchés à la moindre ingestion, alors qu'avec un insecticide classique,
l'efficacité diminue avec le temps après la pulvérisation, et toutes les
parties de la plante ne sont pas touchées.
D’autres PGM peuvent
également être résistantes à des herbicides totaux. Il suffit alors de le pulvériser
dans le champ : toutes les plantes présentes meurent, sauf la plante
transgénique. Un seul herbicide est donc nécessaire.
Ainsi, aux Etats-Unis, ces
PGM ont permis de diviser par cinq l'utilisation d'insecticides sur huit cent
milles hectares de plantation de coton transgénique (photo) résistant à
différents insectes. D'autre part, une nouvelle variété de coton génétiquement
modifiée a été créée : les gènes introduits produisent une coloration de la
plante. Cela permet une réduction de l'utilisation de teinture chimique, très
polluante pour l'environnement. Plant
de coton
![]() La protection des cultures :
La protection des cultures :
La transformation génétique
des plantes vise à améliorer les conditions de culture en développant des
mécanismes de tolérance ou de résistance ayant pour effet d'augmenter les
rendements.
- La résistance aux
conditions climatiques extrêmes :
Une grande partie de la
surface de la planète est impropre à l'agriculture du fait de conditions
défavorables comme le froid, la sécheresse, ou la salinité. Les biotechnologies
pourront apporter une réponse aux pays en voie de développement en créant de
nouvelles espèces adaptées à ces conditions.
- La
résistance aux insectes :
Les pertes occasionnées par
les insectes représentent une part non négligeable des récoltes. En effet, les
insecticides employés jusqu'à maintenant présentent des inconvénients : des
atteintes à l'environnement et l’apparition de formes résistantes d'insectes.
Or, ceci entraîne donc l'emploi de doses croissantes de ces produits. La
synthèse de protéines toxiques pour ces insectes, par modification génétique de
la plante, constitue donc une voie majeure de progrès. La Pyrale est détruite par un insecticide fabriqué par le maïs
transgénique dit « Bt » : le maïs reçoit un gène de scorpion pour résister aux
insectes, ou de pétunia pour résister aux herbicides.

-
La résistance aux maladies :
Sur le même principe, les
biotechnologies s'orientent vers la lutte contre les virus, bactéries, et
autres champignons. Des résultats ont déjà été obtenus sur des plantes comme la
pomme de terre, la tomate ou la betterave : la pomme de terre est dotée d'un
gène de poulet pour résister aux maladies, ainsi que d'un gène humain pour
digérer les métaux lourds. La Pyrale
![]() L’amélioration des conditions d'élevage :
L’amélioration des conditions d'élevage :
-
La lutte contre les maladies animales :
La modification par génie
génétique des aliments destinés à l'élevage peut être un moyen de lutter contre
les maladies animales. Cette alimentation pourrait produire directement des
anticorps ou des vaccins.
- L'amélioration
de la nutrition animale :
L'utilisation du génie
génétique pourrait permettre d'améliorer la qualité nutritionnelle des plantes
utilisées en alimentation animale, en augmentant la teneur en certains acides
aminés (méthionine, lysine, thréonine, tryptophane). Ces éléments, synthétisés
en trop faible quantité par ces plantes, sont actuellement amenés sous forme de
compléments nutritifs. De plus, l'accumulation de certaines enzymes pourrait
permettre d'améliorer la digestibilité des aliments.
![]() Application aux industries
agro-alimentaires :
Application aux industries
agro-alimentaires :
-
L'amélioration de la qualité des aliments :
Quelques exemples :

- Le blé : amélioration des
caractéristiques requises pour
la
panification.
- La pomme de terre :
augmentation de la teneur en amidon pour des utilisations industrielles (purée,
fécule et frites absorbant moins d'huile).
Champ de blé
-
Intervention dans le processus de transformation alimentaire :
Les OGM peuvent intervenir
directement ou indirectement dans le processus de transformation alimentaire.
Deux cas se présentent :
-
soit les
organismes modifiés se retrouvent dans le produit fini, c'est le cas des produits
laitiers où les bactéries améliorant la régularité de la production restent
présentes dans l'aliment,
- soit ils sont éliminés par la chaleur ou par filtration. On peut citer les levures qui réduisent le temps de fermentation de la pâte à pain ou éliminent les saveurs indésirables en produisant des bières plus légères. L'application du génie génétique dans ces domaines en est pour l'instant à la recherche expérimentale.
Ainsi les OGM présentent de nombreux avantages, tant dans le domaine de l’environnement que celui de l’agriculture, ou encore en matière de santé. Ceci nous incite donc à penser que le génie génétique représente un grand progrès pour la science.
Conclusion :
La technique de
transgénèse est encore toute jeune et de nombreuses questions restent en
suspens. On constate qu’elle présente de nombreux avantages mais également des
risques non négligeables. Utilisés de façon appropriée, les OGM pourraient apporter de nombreux moyens pour contribuer à
l’amélioration des conditions de vie. Cependant, la rapidité avec laquelle
peuvent survenir les modifications entraînées par le génie génétique peut avoir
des effets encore inconnus.
Le développement
technologique intéresse directement la population. Dans la plupart des cas, les
interrogations relatives aux OGM sont en lien avec l’environnement. Quant au
processus d’obtention de ces derniers, c’est la transformation du vivant qui
fait l’objet de préoccupations et soulève des questions de nature éthique sur
l’impact que l’avènement de cette nouvelle technologie peut avoir sur la
société et sur les individus qui la composent.
Il y aurait moins
de controverses et le débat serait plus constructif si les applications des OGM
étaient évaluées de façon exhaustive et transparente, et si leurs répercussions
éventuelles étaient prises en considération. Le génie génétique, comme toutes
les innovations scientifiques peut aboutir au pire comme au meilleur. Mais les inquiétudes qui empêchent la réflexion et l’étude, à moyen et
long terme, des conséquences des modifications du vivant sont mauvaises
conseillères. « Toute découverte de la science pure est subversive en
puissance », disait Huxley. Et il ajouta « Toute science doit parfois
être traitée comme un ennemi possible ». Quelles limites doivent alors être
imposées aux recherches scientifiques ? Et par qui ?
Lexique :
ADN Polymérase : Enzyme catalysant
la synthèse de l’ADN.
Bactérie : Micro-organisme unicellulaire formant un règne autonome ni animal, ni
végétal.
Cytoplasme : Terme général désignant tout le
matériel vivant se trouvant à l’intérieur des cellules, exception faite du
noyau.
Enzyme : Substance qui catalyse, accélère une
réaction biochimique.
Génome : Ensemble de l’ADN présent dans le
noyau de chacune des cellules d’un organisme.
Ligase : Enzyme permettant l’union de
deux molécules.
Macromolécule : Molécule géante. Le nombre d'atomes qui la composent dépasse plusieurs
centaines. De ce fait, sa taille est largement supérieure à celle des molécules
simples, comme l'eau ou le glucose. Les molécules du vivant comme l' ADN ou les protéines
sont des macromolécules.
Mellifère : Qui produit du miel.
Noyau : Petite poche souple présente dans les
cellules et qui contient l'ADN.
Nucléotide :
Phase protoplastique :
Plasmide : Petit anneau circulaire d’ADN qui se
trouve et se reproduit naturellement dans les bactéries.
Polymérisation : Union de
plusieurs molécules d’un composé pour former une grosse molécule.
Pore membranaire : Espace vide de la
membrane d’une molécule.
Pyrale : Papillon type d’une famille de
lépidoptère dont les chenilles s’attaquent aux végétaux.
Transgène : Gène ajouté au patrimoine génétique
d’un être vivant.
Tellurique : qui provient de la Terre.
Vacuole : Espace circonscrit, parfois limité par une membrane, au sein du
cytoplasme d’une cellule, à contenu variable.