Chimie
organique :Synthèse et utilisation des ynamides
dans les réactions de
cyclisations radicalaires
I)- Rappels bibliographiques
1)- Introduction
Les triples liaisons font partie des fonctions les plus importantes en chimie organique du fait de leur grand potentiel synthétique.
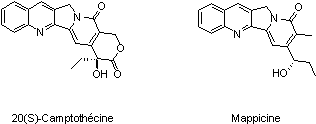
Les ynamines sont des alcynes directement substitués par un atome d’azote. De par leur nature électronique, ceux-ci peuvent induire une sélectivité lors de différents processus chimiques. Sachant que parmi les produits naturels ou les médicaments il existe de nombreuses molécules azotées (Camptothécine, Mappicine), les ynamines apparaissent comme un motif synthétique extrêmement intéressant.
Cependant, la forte réactivité des ynamines ainsi que la difficulté à les préparer et à les manipuler est la cause du peu d'intérêt qui leur a été porté ces quinze dernières années, malgré des études dans les années 1970[1].
Les récentes découvertes d’ynamines protégés par des groupements électroattracteurs nous ont permis de choisir une voie de synthèse d’ynamides, parmi différentes méthodes que nous décrirons, et de les utiliser dans des réactions de cascades radicalaires qui sont étudiées au laboratoire.
2)- Méthodes de synthèse des ynamides
a-
Elimination d'haloènamides
Les méthodes classiques de préparation d'ynamides sont bien décrites dans la thèse de Frédéric Marion[2]. Nous exposerons donc des méthodes de synthèse plus récentes qui permettent un accès aux ynamides.
En 2001, Hsung[3] a
décrit à partir des bromooléfines 2, une
réaction d’élimination permettant d’accéder aux ynamides
possédant un groupe électroattracteur de type oxazolidinone e aussi à des ynamides
chiraux. Un mélange Z/E de β-bromoènamide
2 et 3 est obtenu par bromuration en
β de l’azote avec de bons rendements et l’ynamide
4, par action de tert-butoxyde
de potassium sur le mélange où seul le bromoènamide
de configuration Z subit l’élimination (Figure 1).

Figure 1
b-
Isomérisation propargylique
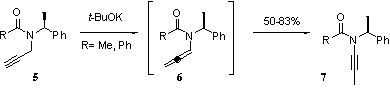 Une précédente méthode de synthèse
avait déjà été publiée en 1999[4], par
le même groupe, en passant par un intermédiaire allènamide
6 avec un rendement global de 80% (Figure 2).
Une précédente méthode de synthèse
avait déjà été publiée en 1999[4], par
le même groupe, en passant par un intermédiaire allènamide
6 avec un rendement global de 80% (Figure 2).
Figure 2
Cette réaction est extensible à
d'autres types d'ynamides[5] :
les ène-ynamides et les diène-ynamides.
Cependant, parmi tous les substrats testés par Hsung
seuls ceux de type 5, conduisent
à un ynamide après formation de l’allènamide.
c- Les
sels d'iodonium
En 1998, Witulski[6] a publié l'utilisation de sels d'iodonium pour la synthèse d'ynamides. Les sels d'iodoniums sont des triples liaisons électrophiles. Ils réagissent mal avec les nucléophiles durs, mais peuvent être substitués par certains nucléophiles mous
.
L'anion de l'amide 8, généré par déprotonation avec le n-BuLi ou le KHMDS dans le toluène, s'additionne selon un processus de type Michael sur le sel d'iodonium 9 pour donner l'anion vinylique 10. Celui-ci élimine du triflate de lithium, ou de potassium, et du iodobenzène pour conduire au carbène 11 qui se réarrange, par migration du groupement R, afin de donner l'ynamide 12 (Figure 3).
Cette réaction fonctionne lorsque le groupement R est un atome d’hydrogène ou de silicium[7], avec des rendements meilleurs dans le cas de l'hydrogène, et peut être appliquée à des groupes attracteurs tels les sulfonamides, les amides insaturés et les trifluoroacétamides.

Figure 3
d- N-alcynylations catalysées par le cuivre
Des exemples plus récents de N-alcynylation catalysées par le cuivre ont été décrites par les groupes de Hsung et Danheiser.
En 2003, Hsung[8] et ses collaborateurs ont mis au point une méthode de couplage entre un amide 13 et un bromoalcyne catalysé par des sels de cuivre (I) (Figure 4).
Parmi tous les amides testés par Hsung, seules les oxazolidinones (X=O) ont conduit à des rendements corrects, mais cette réaction a permis tout de même d'obtenir des ynamides chiraux 14 différemment substitués sur la triple liaison.

Figure 4
![]()

En 2004, Hsung[9] a
publié une autre méthode d'obtention des ynamides
catalysée par le cuivre (I) ou le cuivre (II). Cette méthode de synthèse a pour
avantage d'être plus respectueuse du point de vue environnemental par
l'utilisation de CuSO4 à la place de CuCN
ou CuI. Elle a également permis de diminuer la température de la réaction (on
passe de 110°C à 60-95°C) et de coupler des sulfonamides
17 et des amines hétéro aromatiques 18, en plus des
lactames et des uréthanes (Figure 5).
Figure 5
![]()
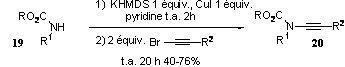
Peu de temps après la première
publication de Hsung en 2003, Danheiser[10] a
également publié des travaux sur le couplage d’ènamides
avec un bromure d’alkynyle catalysé par le cuivre.
Cette méthode est plus efficace et tolère un plus grand nombre de fonctions sur
l’amide et l’alcyne. L’ynamide 20 est formé au
travers d’un mécanisme d’addition oxydante du cuivre pour donner un
intermédiaire du cuivre (III), puis d’une élimination réductrice du métal
(Figure 6).
Figure 6
Les précurseurs utilisés par Hsung ou Danheiser sont principalement des tosylamides ou des carbamates, ainsi qu'un exemple de lactame. Les amides utilisés au laboratoire n’ont pas réagi sur les bromures d’alkynyles dans les conditions décrites précédemment (figures 5 et 6).
3)- Utilisation
des ynamides dans les réactions de cascades
radicalaires
 Cette réactivité des ynamides dans
des réactions de cascades radicalaires est le seul exemple connu dans la
littérature (Figure 7).
Cette réactivité des ynamides dans
des réactions de cascades radicalaires est le seul exemple connu dans la
littérature (Figure 7).
![]()
Figure 7
Les réactions de cyclisation sont
appliquées à des ynamides de type iodobenzyle
ou bromobenzyle avec de bons rendements. Dans le cas
des bromobenzyles, il existe une compétition entre
l'addition du radical tributylétain et l'abstraction
de l'atome de brome qui oblige à utiliser des conditions d'addition lente de
l'hydrure..
Le mécanisme de cette réaction de cyclisation radicalaire est constitué de deux étapes. La première est la cyclisation du radical aryle 24 en 5-exo-dig sur la triple liaison de l'ynamide. La deuxième cyclisation en 6-endo-trig du radical vinylique 25 conduit après réduction au composé tétracyclique 27 voulu (Figure 8).
26 27

25
Figure 8