Exercices
de chimie organique : synthèse et stéréochimie
Exercices
1 Premier
problème : synthèse d’un acide aminé
2 Second
problème : synthèse d’un antiviral
3 Troisième
problème : Produits pharmaceutiques synthétisés industriellement à partir
du Benzaldéhyde
CORRECTION
1 Correction
du premier problème : synthèse d’un acide aminé
2 Correction
du second problème : synthèse d’un antiviral
3 Correction
du troisième problème : synthèse de produits pharmaceutiques
Premier problème : synthèse d’un acide aminé
A1. Combien existe-t-il de stéréoisomères de l’acide cinnamique ? Dessiner les et
nommer les.
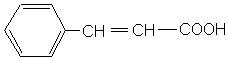
Acide cinnamique
![]()

A2. Quelle relation de stéréochimie relie ces acides cinnamiques ?

A3. Le composé A est traité selon la séquence de réactions suivantes :
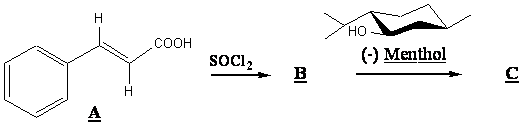
Donner la structure de B et C.

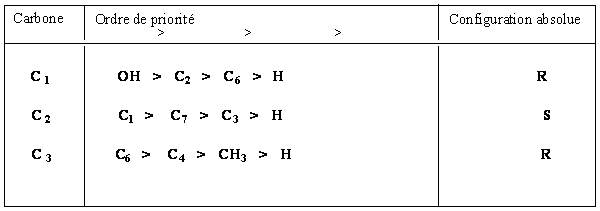
A4. Dénombrer les carbones asymétriques du (-) menthol et donner leur configuration absolue en précisant les ordres de priorité.


A5. Dessiner la structure du (+) menthol en utilisant le cycle prédessiné et donner son pouvoir rotatoire spécifique sachant que celui du (-) menthol est [a] = -50 degrés.
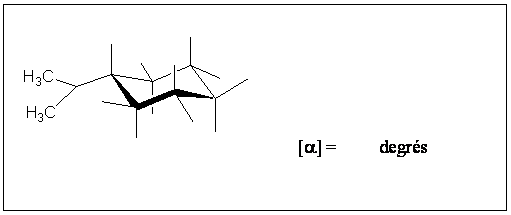
A6. Le composé C obtenu en
question A3, est traité par le brome pour conduire à deux produits D
et D’.
![]()
Donner la structure de D et D’ en projection de Fischer. Le groupement (-) menthyle est représenté par M* et le groupement phényle par C6H5.

Ces composés D et D’ sont-ils : conformères, énantiomères, diastéréoisomères ou identiques ?

A7. Donner le mécanisme de formation de D et D’. On simplifiera les écritures en notant le groupement (-) menthyle par M* et le groupement phényle par F ou C6H5.

A8. En traitant le mélange D + D’ par l’ammoniac puis en séparant les produits obtenus, on obtient l’aziridine E. Ce composé est alors traité par un thiol pour conduire à F. F est transformé en plusieurs étapes en G, un analogue de la cystéïne.
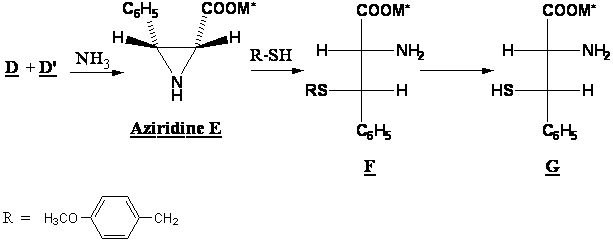
Proposer un mécanisme pour la transformation de E en F qui explique la stéréochimie de la réaction. On s’inspirera de l’ouverture d’époxydes en milieu basique.

A quel type de mécanisme a-t-on affaire ici ? Et quelle est la conséquence de ce mécanisme du point de vue de la stéréochimie?
A9. A quelle série appartient l’acide aminé G ?

Second
problème : synthèse d’un antiviral
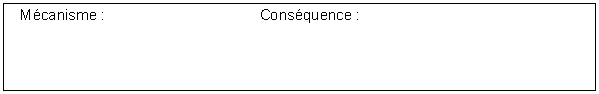
B1. Le composé H est hydrolysé en milieu basique pour conduire à I qui est ensuite converti en J en milieu acide.
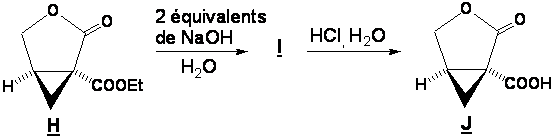
Donner la
structure du composé I.

B2. Donner le mécanisme de formation de J à partir de I.

Pourquoi la réaction I → J, qui est équilibrée, est très favorisée vers la formation de la lactone ?
Répondre en deux lignes.

B3. J est transformé en K
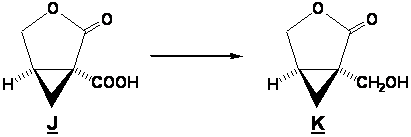
A quel type de réaction a-t-on affaire ici ?

B4. Le composé K est transformé en M selon la suite de réactions suivantes:

Donner la structure de L.

A quoi sert l’amine dans la transformation de K en L ?

Donner le
mécanisme de la transformation de L en M.

B5. M est alors hydrolysé en N (liaison C-Cl hydrolysée). N est transformé en antiviral O.

Donner les réactifs nécessaires à la transformation de N en O et l’ordre dans lequel il faut les utiliser.
Réactifs :

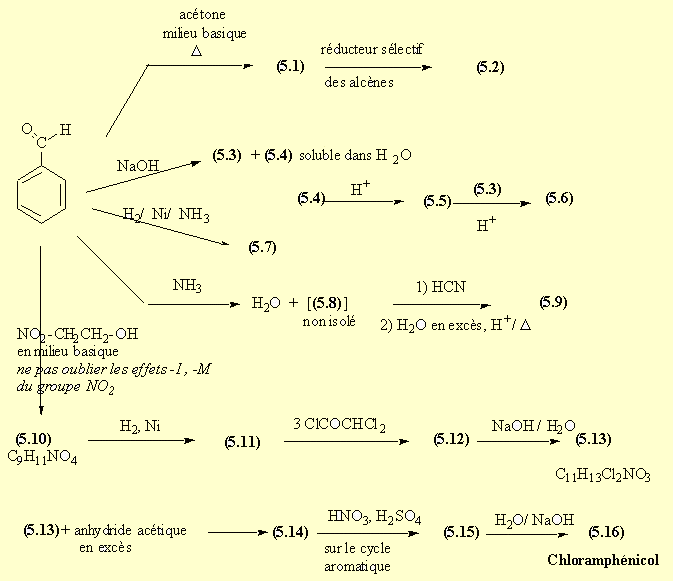
Troisième problème : Produits pharmaceutiques synthétisés industriellement à partir du Benzaldéhyde
A partir du benzaldéhyde,
on fabrique un certain nombre de produits dérivés et des molécules plus élaborées
pour l'industrie pharmaceutique
Remplir les molécules 5.1 à 5.16
Correction
des 5 premiers exercices de chimie organique
Correction du premier problème : synthèse d’un acide aminé
A1. Combien existe-t-il de stéréoisomères de l’acide cinnamique ? Dessiner les et
nommer les.
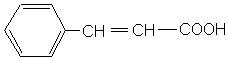
Acide cinnamique
![]()

A2. Quelle relation de stéréochimie relie ces acides cinnamiques ?
A3. Le composé A est traité selon la séquence de réactions suivantes :
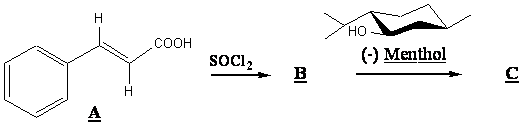
Donner la structure de B et C.

A4. Dénombrer les carbones asymétriques du (-) menthol et donner leur configuration absolue en précisant les ordres de priorité.

A5. Dessiner la structure du (+) menthol en utilisant le cycle prédessiné et donner son pouvoir rotatoire spécifique sachant que celui du (-) menthol est [a] = -50 degrés.
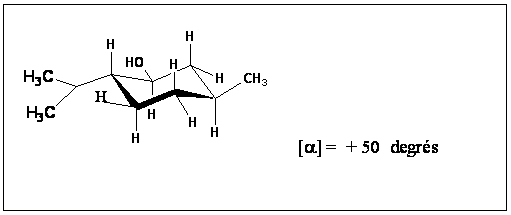
A6. Le composé C obtenu en
question A3, est traité par le brome pour conduire à deux produits D
et D’.
![]()
Donner la structure de D et D’ en projection de Fischer. Le groupement (-) menthyle est représenté par M* et le groupement phényle par C6H5.

Ces composés D et D’ sont-ils : conformères, énantiomères, diastéréoisomères ou identiques ?
A7. Donner le mécanisme de formation de D et D’. On simplifiera les écritures en notant le groupement (-) menthyle par M* et le groupement phényle par F ou C6H5.

A8. En traitant le mélange D + D’ par l’ammoniac puis en séparant les produits obtenus, on obtient l’aziridine E. Ce composé est alors traité par un thiol pour conduire à F. F est transformé en plusieurs étapes en G, un analogue de la cystéïne.
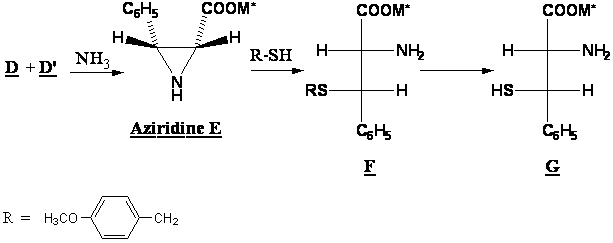
Proposer un mécanisme pour la transformation de E en F qui explique la stéréochimie de la réaction. On s’inspirera de l’ouverture d’époxydes en milieu basique.

A quel type de mécanisme a-t-on affaire ici ? Et quelle est la conséquence de ce mécanisme du point de vue de la stéréochimie?
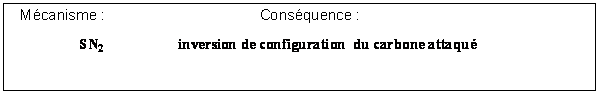
A9. A quelle série appartient l’acide aminé G ?
Correction du second problème : synthèse d’un
antiviral
B1. Le composé H est hydrolysé en milieu basique pour conduire à I qui est ensuite converti en J en milieu acide.
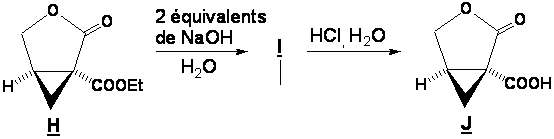
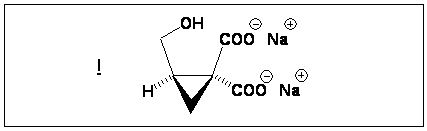
Donner la
structure du composé I.
B2. Donner le mécanisme de formation de J à partir de I.

Pourquoi la réaction I → J, qui est équilibrée, est très favorisée vers la formation de la lactone ?
Répondre en deux lignes.

B3. J est transformé en K

A quel type de réaction a-t-on affaire ici ?

B4. Le composé K est transformé en M selon la suite de réactions suivantes:

Donner la structure de L.

A quoi sert l’amine dans la transformation de K en L ?

Donner le
mécanisme de la transformation de L en M.

B5. M est alors hydrolysé en N (liaison C-Cl hydrolysée). N est transformé en antiviral O.

Donner les réactifs nécessaires à la transformation de N en O et l’ordre dans lequel il faut les utiliser.
Réactifs :

Correction du troisième problème : synthèse de
produits pharmaceutiques
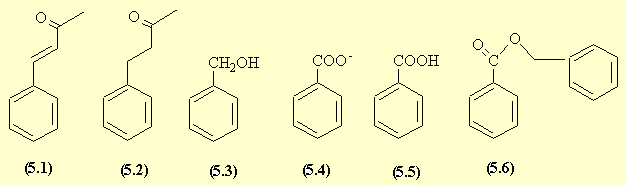
- L'aldolisation croisée (AdN) entre l'acétone qui fournit le carbanion et l'aldéhyde benzoïque, suivie d'une déshydratation donnent le produit (5.1).
- La réduction sélective de la double liaison conduit à la benzylacétone (5.2).
- La réaction de Cannizzaro donne accès à l'alcool benzylique (5.3) et au benzoate de sodium (5.4) qui en milieu acide est transformé en acide benzoïque (5.5).
- La réaction de (5.3) et de (5.5) conduit au benzoate de benzyle (5.6).
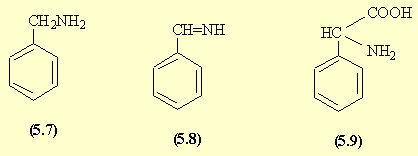
- L'amination réductive du benzaldéhyde donne la benzylamine (5.7). La réaction de Strecker par l'intermédiaire de l'imine (5.8) puis de l'aminonitrile conduit à la phénylglycine (5.9).
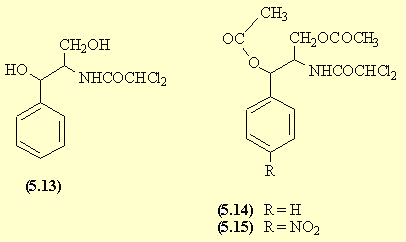
- Le carbanion du nitroéthanol don ne une AdN sur le benzaldéhyde.
- La réduction du groupe NO2 fournit l'amine (5.11). Il n'est pas possible de faire réagir un seul équivalent de chlorure d'acide sur l'amine; on fait réagir trois équivalents et on forme ainsi l'amide mais aussi les esters.
- Une saponification dans des conditions douces permet la saponification des esters mais conserve la fonction amide dans la molécule (5.13). Les fonctions alcool sont protégées pour l'étape suivante par estérification sous forme d'acétate.
- Une nitration du cycle aromatique SE est réalisée; l'isomère para (5.15) est favorisé par encombrement stérique. La saponification des esters permet de retrouver les fonctions alcool du chloramphénicol (5.16).

b )
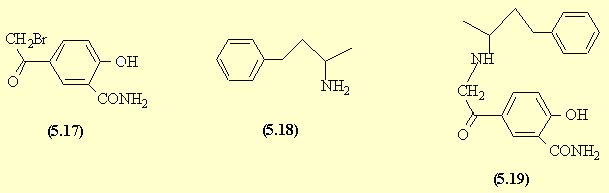
- En présence d'AlCl3, on favorise la SE sur le
cycle aromatique en position para pour des problèmes d'encombrement
stérique. Si le bromure d'acide réagit sur le phénol, on obtient l'ester :
le bromoacétate correspondant. L'amination
réductive de la phénylbutanone donne l'amine
correspondante (5.18). Une SN2 de l'amine déplace le brome
activé par le carbonyle en a et conduit à l'aminocétone
(5.19) qui est réduite en alcool : le labétalol
(5.20).