SOMMAIRE
I Présentation de
la réaction :
b) Synthèse régioselective de l’éther silylé
d’énol :
d) Observations de Teruaki Mukaiyama lors de sa première
publication :
a) Rôle et caractérisation des acides de Lewis :
a) Les triflates de lanthanide.
Réaction d’aldolisation de Mukaiyama en phase aqueuse
catalysée par CDP-Yb(C4-amide)3
Réaction d’aldolisation de Mukaiyama catalysée par CDP-Yb(C4-amide)3
dans le dichlorométhane
V) Les applications récentes :
a) Synthèse de pyrroles faisant intervenir une réaction
de Mukaiyama :
b) Application à des médicaments :
c) Synthèse de polymères grâce à la réaction de Mukaiyama
Introduction
La réaction de Mukaiyama
est une des réactions les plus étudiées actuellement car cette synthèse est une
bonne manière de créer une chaîne carbonée. Elle permet aussi un très bon contrôle
de la chiralité de la molécule formée. Cette réaction est de plus en plus
utilisée en synthèse organique. De manière à limiter l’impact de ces synthèses
sur l’environnement, nous avons étudié cette réaction avec l’eau pure comme
solvant. Les catalyseurs utilisés n’étant pas tous stables dans l’eau, les
chercheurs utilisent en plus des surfactants.
I Présentation de la réaction :
a) La réaction de Mukaiyama
Mise au
point pour la première fois en 1973[1], la
réaction de Mukaiyama est une réaction de
condensation des éthers d’énol silylés sur un composé
carbonylé, catalysée par un acide de Lewis. Elle entraîne la formation de
liaison carbone-carbone. Il s’agit d’une réaction permettant l’obtention
d’aldols.
Bilan de la
réaction :
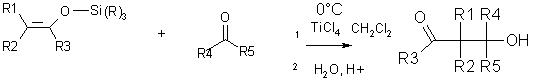
TiCl4 est un acide de Lewis qui joue le
rôle d’activant sur le carbone du CO. Parmi les différents
acide de Lewis testés, il est celui qui conduit alors au meilleur
rendement (92%). L’éther d’énol joue le rôle du nucléophile, la cétone, celui
d’électrophile. La réaction de couplage est effectué à –78°C pour les
aldéhydes, mais les cétones moins électrophiles nécessitent 0°C, voire la
température ambiante.
Mécanisme
de la réaction [2] :
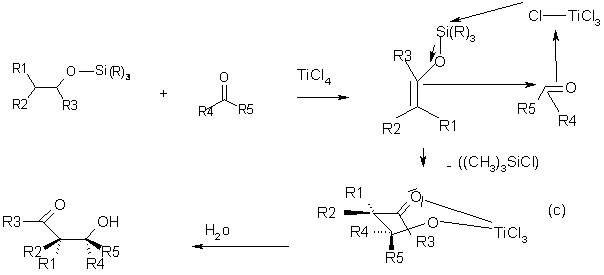
Un éther
silylé d’énol peut attaqué facilement un
composé carbonylé, activé par le tetrachlorure de
Titane (catalyseur), sous forme d’une
réaction nucléophile. On passe alors par un intermédiaire chélate ©, stable.
L’hydrolyse de © permet d’obtenir l’aldol. Lors de son expèrience
en 1974, Mukaiyama n’a détecté aucun silyl ether (1) et aucun produit
d’élimination (2). Ce résultat est dû selon lui à la forte activation du groupe
carbonyle accepteur par le TiCl4 ainsi qu’à la
grande affinité de ce métal pour l’oxygène.

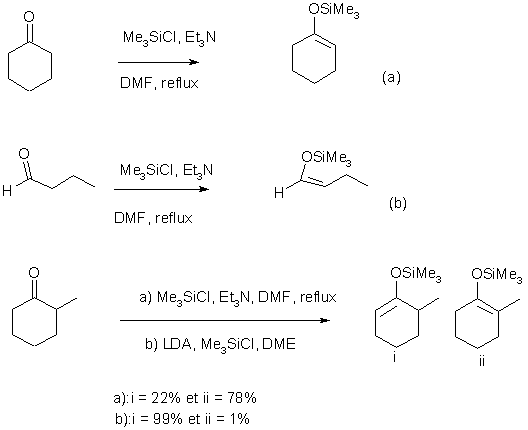
b) Synthèse régioselective de l’éther silylé d’énol :
Ces composés ont une utilité qui surpasse celle des autres dérivés énols, par leur facilité de préparation et leur voie de désilylation douce. Ils combinent une bonne réactivité, mais surtout une grande sélectivité. Les méthodes classiques de préparation des éthers silylés d’énol sont les réactions des énolates avec des chlorosilanes ou les réactions d’hydrosylation de composés carbonyles a, b insaturés.
Méthode de
House : Publié en 1968, House utilise la triéthylamine
dans le DMF a reflux. Dans le cas de la cétone symétrique (a) et de l’aldéhyde
(b), les rendements obtenus sont bons. Dans le cas de cétones dissymétriques,
on utilise d’autres conditions, a savoir le diisopropylamidure de lithium (LDA) dans le THF. On obtient
alors l’éther triméthylsilylé d‘énol
cinétique. Alors que si on part du couple Et3N/DMF, un mélange de
deux énantiomères est formé. Je pense que dans le cas de cétone dissymétrique,
la régioselectivité varie selon les substrats de
départ.(c) et (d)
Dans les chlorosilanes, la liaison Si-Cl est grande, et on obtient
en fait une réaction identique à l’attaque d’un dérivé chloré, qui est polarisé
et dur, sur le site dur de l’énolate, à savoir
l’anion oxygène.
c) Rôle de l’eau :

Des
recherches menés sur la réaction de Mukaiyama se sont portés sur le développement d’acide de
Lewis stable dans l’eau, comme par exemple InCl3[5].
Initialement, de mauvais résultats ont été observés pour certain acide de
Lewis, avec des rendements très variés, du fait d’une décomposition de ces
acides par l’eau.
L’éther d’énol silylé est très sensible à l’eau, spécialement sous des conditions acides, et si l’acide de Lewis hydrolyse dans l’eau, l’éther d’énol se décompose rapidement et la réaction n’a pas lieu. Il a donc été montré qu’il était préférable de mélanger au préalable l’aldéhyde et l’acide de Lewis puis d’additionner l’éther d’énol suivi par l’eau. En fait l’addition de tous les réactifs ensembles permet probablement une meilleure agrégation des composés organiques, permises par la pression interne de l’eau, ce qui renforcent les interactions hydrophobes.[6]
Ces
constatations ont poussés les chercheurs à connaître les conditions optimales
pour réussir la réaction d’aldolisation dans l’eau, solvant ayant la
caractéristique de ne pas coûté cher.
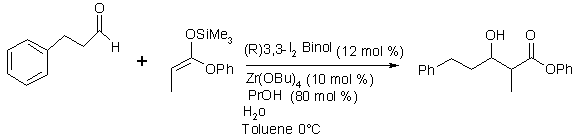
Des
études ont été réalisées à partir de la réaction suivante :
Des
chercheurs ont montrés que l’eau tenait un rôle important dans cette réaction,
permettant notamment d’accroître de façon significative le rendement. Ils ont
tout d’abord constatés qu’en absence d’eau, le
rendement obtenu n’était que de 38%. Ils ont alors ajoutés, une faible quantité
d’eau 5% molaire, puis 10% molaire. Le rendement de la réaction est alors passé
respectivement à 62 et 65%. Cependant un excès d’eau n’a pas permis d’obtenir
l’aldol souhaité. Ce qui montre bien les limites de l’eau, pouvant provoquer
des réactions intermédiaires, ou l’hydrolyse de l’acide de Lewis. L’aldol
obtenu est majoritairement anti.
L’eau joue
en fait un rôle dans la formation du catalyseur. En effet, si la réaction
précédente est effectué en utilisant des alcools
secondaires ou tertiaires, le rendement et la sélectivité diminue.
De la même
façon que pour Incl3 , les chercheurs ont
trouvés des acides de Lewis qui était soluble et stable dans l’eau, tel que les
lanthanides triflates, évitant ainsi l’utilisation d’autres solvants plus
toxique. Leur stabilité et leur activité catalytique ont été attribué
à leur grand rayon ionique, et à un équilibre entre les acides et l’eau.
d) Observations de Teruaki Mukaiyama lors de sa première publication :
* Comme nous connaissons les problèmes de régiosélectivité dans la formation des énolates, on a cherché à comparer les produits obtenus pour cette réaction d’aldolisation en partant de deux éthers d’énol silylé isomère de structure.
On a donc
fait réagir l’éther d’énol silylé thermodynamique (le plus stable : A)
avec du benzaldéhyde en présence de catalyseur et on
a constaté la formation de deux stéréoisomères
stabilisé par liaison H.
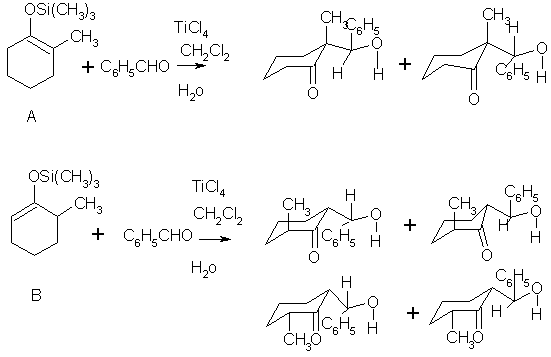 On a
ensuite fait réagir l’éther d’énol silylé cinétique (le moins substitué
(-78°C) :B) avec également du benzaldéhyde
en présence de catalyseur et on a constaté la formation de quatre stéréoisomères tous stabilisés par liaison H. Cela est due
au fait que lors de cette réaction, l’isomère conduit à un aldol possédant
d’avantage de configurations possibles .
On a
ensuite fait réagir l’éther d’énol silylé cinétique (le moins substitué
(-78°C) :B) avec également du benzaldéhyde
en présence de catalyseur et on a constaté la formation de quatre stéréoisomères tous stabilisés par liaison H. Cela est due
au fait que lors de cette réaction, l’isomère conduit à un aldol possédant
d’avantage de configurations possibles .
* Par ailleurs Mukaiyama
a testé l’utilisation de sa réaction d’aldolisation
en utilisant différents groupements carbonyles, tels que l’aldéhyde, la cétone
et l’ester.
En les
faisant réagir sur le même éther d’énol silylé, il a constaté que la réaction
avec l’aldéhyde était beaucoup plus rapide, que celle avec la cétone et
l’ester.
En effet,
on se souvient que l’interaction des orbitales prédominante lors de l’addition
d’un nucléophile (ici l’éther d’énol) sur un groupe carbonyle est celle qui met
en jeu la BV de l’aldéhyde et la HO du nucléophile. Or l’aldéhyde est plus réactive que la cétone, car sa BV est plus basse.
Le
rendement obtenu avec l’aldéhyde est ainsi plus important qu’avec une cétone.
Avec un ester, aucun aldol n’est obtenu.
II) Les acides de Lewis :
a) Rôle et caractérisation des acides de Lewis :
En ayant
découvert que certains acides de Lewis étaient stables dans l’eau et
permettaient d’accroître le rendement de la réaction, les chercheurs ont eu
l’idée de comparer les capacités catalytiques de différents acides de Lewis en
fonction du métal utilisé.
Les
résultats montrent que certains sels chlorés catalyse la réaction, et que
d’autres n’entraîne la formation que de traces. Le métal utilisé joue un rôle
prépondérant.[4]
|
Métaux
dont le sel chloré donne un Bon
rendement. |
Métaux dont le sel chloré n'amène pas à l'aldol, ou
entraîne une trace. |
|
Fe(II), Cu(II), Zn(II),
Cd(II), In(III), Pb(III), Sc(III), Y(III), Ln(III) |
B(III), Si(IV), P(III), P(IV), Ti(IV),
V(III), Ge(IV), Zr(IV), Nb(V), Mo(V), Sn(IV), Sb(V), Hf(IV), Ta(V), W(VI),
Re(V), Ti(III), Li(I), Na(I), Mg(II), Al(III),
K(I), Ca(II), Cr(III), Mn(II),
Co(II), Ni(II), Ga(III),
Ru(III), Pd(II), Ag(I),
Os(III), Ir(III), (Pt(II), Au(I), Hg(II). |
Certains
sels chlorés provoquent la décomposition rapide de l’éther d’énol silylé et aucun aldol n’est
obtenu.
Cela est du
au fait que l’hydrolyse des métaux chlorés
est très rapide et l’éther d’énol silylé est alors protonné puis
hydrolysé évitant du même coup le produit souhaité.
Mais
d’autres acides de Lewis sont stable dans l’eau mais ont une capacité
catalytique faible amenant au même résultat.
Une
corrélation a été trouvé entre
l’activité catalytique dans l’eau de certains acide de
Lewis et la constante d’hydrolyse des métaux (Kh).
Cette
constante se calcule ainsi : x Mz+ + y H2O = Mx(OH)y(xz-y)+ + y H+
pKh= - log Kxy
![]() Avec Kxy = [Mx(OH)y(xz-y)+][ H+]* gxy*(gH+)y
Avec Kxy = [Mx(OH)y(xz-y)+][ H+]* gxy*(gH+)y
[Mz+] (gMz+)x
aH2Oy
Ainsi, les
catalyseurs métalliques qui ont un rendement supérieur à 50% en aldol, ont une
valeur de pKh compris entre 4,3 et 10,08.
La raison est que les cations sont généralement difficile à hydrolyser
quand leur valeur de pKh est grand.
Si cette valeur est inférieur à 4,3 les cations sont facilement hydrolysable et
l’ion oxonium se forme (addition d’un proton H+). Sous ces
conditions, l’éther d’énol se décompose facilement.
Enfin, si la valeur du pKh est supérieur à 10,08, le cation est trop stable.
Cette valeur
spécifique est étroitement lié à l’énergie
d’hydratation, qui joue un rôle quant à l’acidité de Lewis des cations. En
effet, les cations qui ont une valeur de pKh
très élevé n’ont besoin que d’une faible quantité d’énergie d’hydratation, si
bien que leur acidité de Lewis est nécessairement bas.
Le deuxième
paramètre qui influe sur la capacité catalytique du cations
métallique est la constante d’échange de l’eau (WERC). Les bons
rendements sont tels que cette valeur soit supérieur à
3,2 * 106 M-1S-1.
Tous ces
paramètres influent également sur la stéréosélectivité
des produits obtenus. En utilisant comme catalyseur InCl3 et CeCl3,
qui remplissent au conditions précédentes, on obtient bien des rendements
supérieur à 50%, mais on constate que InCl3 conduit presque
intégralement à un aldol syn, tandis que CeCl3
amène à un mélange de syn et d’anti.
[3]
On a alors
constaté que la réaction suivante pouvait se produire, lorsque la quantité de
CeCl3 introduite était importante :
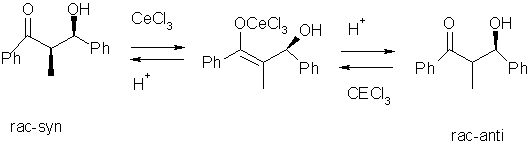
L’explication proposée par les chercheurs est que l’acidité
de Lewis de Ce(III) serait supérieur à celle de
In(III), favorisant un mélange de syn et anti.
b) Le bore :
La réaction
d’aldolisation de Mukaiyama,
stéréoselective, du cis-propiophénone
triméthylénolate avec le benzaldéhyde
est très performante dans l’eau. Elle nécessite la présence d’un acide de Lewis
sous forme de molécules « cages » associées à l’acide benzoïque.
Les
meilleurs résultats : 93% de rendement et une sélectivité syn (syn/anti = 94/6) sont obtenus à 0°C avec 0.1 équivalent de Ph2BOH,
0.1 équivalent de SDS et 0.01 équivalent de PhCOOH.[15]
Des études
récentes ont développé l’utilisation des acides de Lewis sous forme de
molécules « cages » (LASCs) comme catalyseurs dans les synthèses
organiques en phase aqueuse.
Ces
molécules créent des particules colloïdales d’environ 1 µm de diamètre avec des
molécules organiques dans l’eau et sont utilisées dans les
réaction de synthèse telles que Mannich,
Michael et l’aldolisation de Mukaiyama.
Cette
dernière est un modèle de réaction. En effet, après plusieurs essais, Ph2BOH
(1.), acide diphénylborique, qui est très
stable dans l’eau s’est révélé être un excellent catalyseur en présence de SDS
comme molécule cage. Les résultats sont reportés dans le tableau 1.
Tableau 1. Réaction
d’aldolisation de Mukaiyama
dans l’eau utilisant 1.
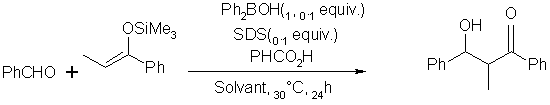
|
ENTREE |
SOLVANT |
PhCO2H
(équivalent) |
RENDEMENT (%) |
SYN/ANTI |
|
1 |
H2O |
- |
trace |
- |
|
2 |
H2O |
0.01 |
90 |
92/8 |
|
3(b) |
H2O |
- |
2 |
53/47 |
|
4(b) |
H2O |
0.01 |
27 |
58/42 |
|
5(c) |
H2O |
0.01 |
4 |
91/9 |
|
6(d) |
H2O |
0.01 |
93 |
94/6 |
|
7 |
Et2O |
0.01 |
trace |
- |
|
8 |
CH2Cl2 |
0.01 |
trace |
- |
|
9 |
- |
0.01 |
24 |
90/10 |
|
(a)sulfate de sodium/
(b)without 1 / (c)without SDS/ (d)0°C |
||||
D’autres
exemples d’aldolisation sont résumés dans le tableau 2.
Tableau 2 .Réaction
de Mukaiyama utilisant 1. dans l’eau
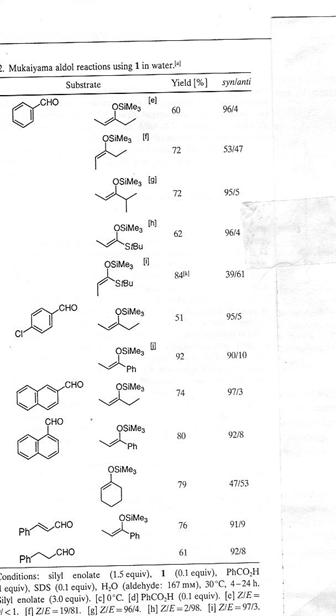
Dans
tous les cas, les réactions se produisent très bien en présence de Ph2BOH (0.1
équivalent), SDS (0.1 équivalent) et PhCOOH (0.01
équivalent). Lorsque le Z-3-triméthylsiloxy-2-pentène est utilisé, on obtient
les meilleurs résultats.
D’une
manière plus générale, une très forte selectivité syn est obtenue avec l’utilisation des
Z-énolates (syn/anti = 90/10 – 97/3). L’énolate de Bore peut réagir rapidement avec un aldéhyde ou
être hydrolysé pour former la cétone correspondante.
Les aldolisations diastéréoselctives
utilisant des énolates de bore sont particulièrement
performante dans l’eau. Elles se produisent en phase aqueuese
à température ambiante, alors que les réactions d’aldolisation
utilsant du bore traditionnel nécessite des comditions expérimentales strictes, à savoir de très basses
températures et un milieu complètement anhydre.
L’eau est
donc un environnement hospitalier à l’aldolisation de
Mukaiyama utilisant des énolates
de bore comme catalyseur.
c) Le gallium
Dans le
même procédé que pour les lanthanides Ln(OTf)3 , d’excellents résultats sont
obtenus, notamment l’ee et syn,
lors de l’utilisation du catalyseur Ga(OTf)3 .
La
combinaison du Ga(OTf)3
ou GaCl3 avec un ligand semi couronné utilisé comme un
acide de Lewis catalyseur dans l’aldolisation de Mukaiyama en phase aqueuse est très efficace et donne de
très bons rendements et diastéréo- et énantiosélectivités. [7]
d) Le zirconium
L’aldolisation asymétrique catalysée entre des éthers d’énol silylés et des aldéhydes,
comme celle de Mukaiyama sont
très performants lorsque le zirconium est utilsé
comme catalyseur.
De très
hauts rendements et diatéréo- et énantioselectivités
sont obtenus.
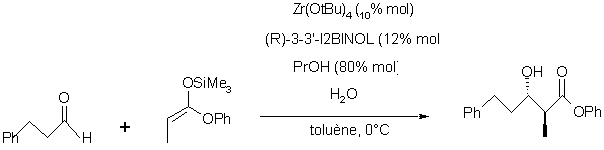
Les
catalyseurs sont d’abord préparés à partir du zirconium (IV) tert-butoxide (Zr(OtBu)4),
(R)-3,3’-diiodo-1,1’-binaphtalène-2,2’-diol ((R)-3,3’-I2BINOL), un
alcool primaire et une petite quantité d’eau.
Il est noté
en premier lieu que les alcools primaires jouent un rôle important en
complétant le cycle catalytique, et en second lieu qu’une petite quantité d’eau
était essentielle pour obtenir de bonnes sélectivités.
De plus,
les activités des catalyseurs à base de zirconium chiraux croient en utilisant
de nouveaux ligands, (R)-3,3’-I2-6,6’-X2BINOL (X = Br, I, C2F5) ; et il a été
montré que même les réactions d’aldolisation
utilisant des substances peu réactives se déroulant correctement en utilisant
ces catalyseurs.
Enfin, les
études RMN de ces réactions sont performantes, ce qui suggère que la catalyse formeraient une structure dimerique
et que l’eau affecte sensiblement la réaction.
Récemment
plusieurs acides de Lewis, tels que Sn, B, Cu, Ti, etc. ont été utilisés et
étudiés dans des réactions d’aldolisation asymétrique. Dans beaucoup de systèmes, les
réactions se déroulent correctement sous des conditions expérimentales
totalement anhydres et à basse température pour obtenir de bons résultats.
Des
chercheurs ont montré que les catalyseurs chiraux à base de zirconium préparés
à partir de zirconium alkoxide et
1,1-binaphtalène-2,2’-diol (BINOL), donnaient de très bons rendements et cela
dans des conditions douces. Dans beaucoup de cas, et sous ces conditions,
l’aldol anti est obtenu. De plus, en ajoutant une
petite quantité d’eau , des chercheurs se sont aperçus
que celle ci était nécessaire au système catalytique, et influençait beaucoup
sur les résultats qui croient en fonction de la quantité d’eau dans le milieu.[14]
|
ENTREE |
H2O (mol%) |
RENDEMENT
(%) |
SYN/ANTI |
EE (%) |
|
1 |
- |
38 |
12/88 |
85 |
|
2 |
H2O (2) |
37 |
16/64 |
79 |
|
3 |
H2O (5) |
62 |
14/86 |
89 |
|
4 |
H2O (10) |
65 |
15/85 |
88 |
|
5 |
H2O (20) |
61 |
14/86 |
89 |
|
6 |
H2O (40) |
trace |
- |
- |
Cependant, on remarquera que 5 à 20 % molaire en eau dans le mélange réactionnel donnait de meilleurs résultats, mais à partir de 40 %, la réaction n’a plus lieu.
Rôle de
l’eau :
En présence
d’eau, les réactions nécessitent des alcools primaires comme l’éthanol, le propanol ou le butanol, qui
donnent de très bons rendements et enantiosélectivités.
Les alcools
tertiaires et secondaires comme 2-propanol ou encore le phénol apportent de
très mauvais résultats.
L’importance
et rôle de l’eau dans ces réactions sont également révélées
lors des analyses RMN. En l’absence de PrOH et d’eau,
un spectre de 13C est obtenu par combinaison de Zr(OtBu)4
et (R)-3,3’-I2BINOL .
Lorsque PrOH est ajouté au système, de systèmes plus complexes
apparaissent et des signaux apparaissent encore plus clairs lors de l’addition
de H2O. En fait l’eau restructure le système catalytique. La
réaction d’aldolisation asymétrique anti-sélective a
été développé à 0°C, sous des conditions expérimentales douces apportant le
produit désiré : l’aldol, et ce avec des hauts rendements et sélectivités,
en utilisant un catalyseur chiral à base de zirconium préparé à partir de Zr(OtBu)4, (R)-3,3’-I2BINOL, un alcool et de l’eau.
III Lanthanides :
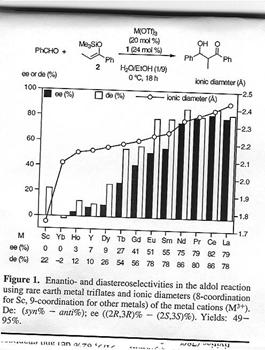
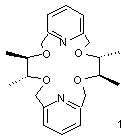
a) Les triflates de lanthanide.[13]
Définition : Nom
générique des éléments dont le numéro atomique est compris entre 57 et 71.
Lanthanides
trifluorométhanesulfate Ln(Otf)3 ( Tf = triflate = F3 CSO2 )
La catalyse
d’aldol asymétrique a été réalisée pour la première fois en utilisant un
éther couronné chiral.
Réactions :
Les
réactions catalysées par les acides de Lewis sont les plus efficaces dans la
synthèse chimique moderne. Parmi les
acides de Lewis les plus étudiés, les lanthanides trifluoromethanesulfate
(lanthanide triflates, Ln(Otf)3 )ont reçu plus d’attention à cause de leur
forte acidité, au sens de Lewis, et de leurs exceptionnelles propriétés. En
particulier, leur nature hydrophile a conduit aux développements des réactions
catalysées par des acides de Lewis en phase aqueuse.
Ces
réactions ont un grand avantage par rapport aux réactions conventionnelles
utilisant des solvants organiques et des acides de Lewis comme médiateurs,
parce que les procédures d’extraction et catalyseurs ne sont plus nécessaires.
Ce pendant,
les réactions de catalyse asymétrique utilisant Ln(Otf)3 en
milieu aqueux n’ont pas encore fait preuve de rapport.
Nous
étudierons alors le premier exemple d’aldolisation
asymétrique catalysé par Ln(Otf)3 en phase aqueuse.
La
caractéristique la plus importante désignant un ligand de Ln(Otf)3 pour
les réactions en phase aqueuse est sa propriété de se lier aux cations .
Un ligand
avec un fort degré de coordination conduit souvent à la réduction de l’acidité
du cation métallique et donc à un faible rendement du produit désiré.
D’autre part , la faible habilité à se lier des ligands aboutit
à la création des cations métalliques libres coordinées
par des molécules solvant en dépit de ligands. Cela amène à une baisse de la régiosélectivité du produit.
Le problème
a été résolu en trouvant un ligand chiral ayant une forte habilité à se lier et
ne réduisant pas l’acidité de Ln(Otf)3
.
Récemment,
des études ont montré que l’association de Ln(Otf)3 et
d’éthers couronnés chiraux peut être utilisé comme une acide de Lewis dans les
réactions d’aldolisation en phase aqueuse.
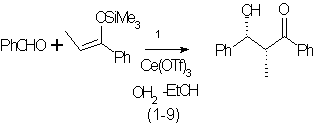
Exemple de
réaction :
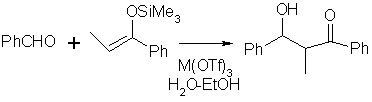
On obtient
un rendement de 85% avec :
·
Une forte diastéréoselectivité
Ø
Syn/anti = 91/9
Ø
82% de
·
Une forte enantioselctivité
Ø
78% ee
pour l’isomère (2R,3R)
b) Rôle de l’eau :
Dans ces
réactions, l’eau joue un rôle primordial pour les rendements et sélectivité.
Lorsque la réaction est faite avec de l’éthanol pur, des résultats plus bas
sont observés (rendement de 51% , 70%de,23% ee pour (2R,3R))
La même
réaction dans le dichlorométhane pur apporte de plus
mauvais résultats encore (rendement de 3% au bout de 185h, 28%de et 22% ee)
Toutes ces
expériences et résultats ont permis d’établir une évaluation systématique des
lanthanides Ln(Otf)3 utilisés lors des réactions d’aldolisation en phase aqueuse.
Le diamètre
ionique affecte de facon significative la
sélectivité.
En effet,
pour des cations larges comme La, Le, Pr et Nd ,
la diastéréo- et énantioselectivités
sont élévées. Les petits actions comme Sc et Yb ont des sélectivités
quasi nulles.
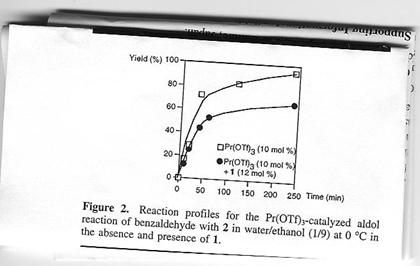
La figure
suivante montre le profil de réaction pour l’aldolisation
en présence et absence de (1).
Ceci montre que même si (1) décélère la réaction, la réactivité reste bonne.
Par
conséquent, la présence d’un acide de Lewis, comme Ln(Otf)3 est
le facteur clé dans l’aldolisation asymétrique
catalysée.
Le principe
des ces réactions est basé sur les effets de la taille des ligands macro-cycliques.
En effet,
la taille du diamètre ionique affecte beaucoup la diastéréo-
et énantioselectivités de l’aldol obtenu.
IV Les surfactants :
a) Les cyclodextrines
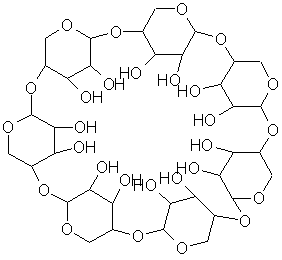 Définition :
Définition :
Les cyclodextrines
sont des molécules cages naturelles obtenues par dégradation enzymatique de
l'amidon. Elles se présentent sous forme d'oligomères cycliques du glucose et
comportent de 6 à 12 unités. Les plus abondantes sont les hexamères (a-cyclodextrine), heptamères (b-cyclodextrine)
et octamères (g-cyclodextrine).
Cette molécule se présente sous la forme d'un abat-jour. Tous les groupes
polaires (hydroxyles OH) sont localisés à l'extérieur, l'ensemble
délimitant une cavité relativement hydrophobe. Ce caractère amphiphile permet
aux cyclodextrines d'inclure dans leur cavité des
molécules hydrophobes pour former des complexes d'inclusion solubles dans
l'eau.
Principales applications :
Domaine pharmaceutique :
Le mode d'administration d'un médicament joue très souvent un rôle déterminant dans l'expression de l'activité pharmacologique. L'encapsulation du principe actif dans une molécule hôte constitue une des approches les plus récentes et le plus prometteuses du transport des médicaments. Leur caractère biodégradable les prédispose à des applications importantes dans les domaines agro-alimentaires et pharmaceutiques. L'encapsulation dans les cyclodextrines permet en effet de protéger des molécules fragiles ou d'assurer leur libération lente et contrôlée. De plus, la solubilisation de médicaments insolubles dans l'eau sous forme de complexes d'inclusion dans les cyclodextrines permet de disposer de préparations injectables. Ce processus s'applique à de très nombreux médicaments insolubles dans l'eau et dans les fluides physiologiques (anti-inflammatoires, stéroïdes, anti-tumoraux, ...). L'inclusion de ces composés dans les cyclodextrines en milieu aqueux est mis en évidence par RMN. En association avec l'informatique moléculaire, cette technique permet d'accéder à la structure tridimensionnelle du complexe d'inclusion en solution. Ultérieurement, on peut modifier chimiquement cette cyclodextrine pour optimiser les interactions entre la molécule incluse et la cyclodextrine, pour augmenter la solubilité dans l'eau du complexe d'inclusion ou pour diriger ce complexe vers l'organe à traiter. Ce dernier aspect constitue le "ciblage moléculaire". Dans cette approche, le transporteur doit permettre d'acheminer le médicament vers le site où son action doit s'exprimer. Les cyclodextrines apparaissent donc comme d'excellents candidats pour optimiser l'action des médicaments, en particulier pour ceux très peu solubles dans l'eau. La synthèse des dérivés de ces cyclodextrines est également un élément incontournable de l'amélioration de leurs propriétés.
Exemple : augmentation de la solubilité du taxotère (médicament anticancéreux) dans l’eau par 1000.
Domaine textile :
On peut greffer et polymériser les cyclodextrines dans le but d’obtenir des polymères
fonctionnels, des supports ou des matériaux qui présentent les propriétés de
ces dernières. Les applications sont basées sur la capture ou la libération
retardée et sélective de composés organiques.
Exemple : des cyclodextrines
greffées sur les fibres textiles serviront notamment à stocker les mauvaises
odeurs dans le vêtement mais cette adsorption ne doit à aucun moment être
réversible (sauf au lavage).
Domaine chimie analytique :
Séparations analytiques chirales directes utilisant les cyclodextrines.
Cosmétologie :
Les cyclodextrines entrent dans la formule de shampooings et de crèmes.
Agrochimie :
Les cyclodextrines servent à encapsuler les phéromones sexuelles d’insectes ainsi les effets de ces phéromones sont sensibles plus longtemps car leur dispersion est moindre. Ces phéromones servent à piéger les insectes nuisibles aux cultures.
Utilisation des cyclodextrines
pour la réaction de Mukaiyama :
Les
complexes de cyclodextrines et lanthanides appelés
Modèle metallo-enzyme sont
des acides de Lewis, catalyseurs très efficaces et recyclables, qui peuvent
promouvoir l’aldolisation de Mukaiyama
dans l’eau pure.
Alors
comment conçoit-on un Modèle metallo-enzyme constitué d’un acide de Lewis catalyseur et
d’une poche hydrophobe, et son immobilisation dans l’eau pure ?
Les cyclodextrines (CD)
sont des molécules « hôtes » naturelles et peuvent former des
complexes insolubles avec des molécules organiques.
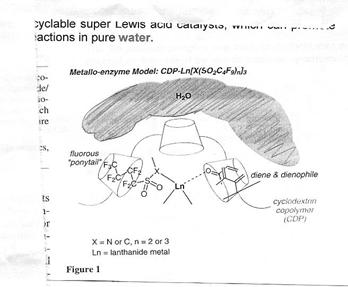
L’interaction
hydrophobe entraîne la formation de complexes avec des molécules
« cages » fluorées. Prenons l’exemple du complexe Cd-Yb
qui se recycle complètement lors de la réaction d’aldolisation
de Mukaiyama faisant réagir du benzaldéhyde
avec du KSA ; dérivé du méthylisobutyrate ;
dans l’eau.
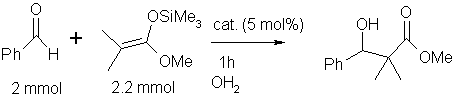
Réaction
d’aldolisation de Mukaiyama
en phase aqueuse catalysée par CDP-Yb(C4-amide)3
|
Cycle |
Rendement
(%) |
|
1 |
74 |
|
2 |
72 |
|
3 |
73 |
Ce complexe est donc très efficace et très immobile malgré l’instabilité du KSA en phase aqueuse. Pour éviter la décomposition de KSA dans l’eau, l’aldolisation de Mukaiyama est réalisée dans un solvant organique, comme le dichlorométhane par exemple. Bizarrement, les résultats obtenus sont excellents contrairement à la réaction de Diels-Alder dans les mêmes conditions.
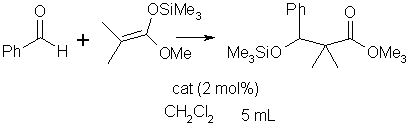
Réaction
d’aldolisation de Mukaiyama catalysée par CDP-Yb(C4-amide)3
dans le dichlorométhane
|
Cycle |
Rendement
(%) |
|
1 |
99 |
|
2 |
99 |
|
3 |
99 |
|
4 |
98 |
|
5 |
99 |
L’utilisation
de tels complexes est très intéressante et donne de très bons résultats en
milieu aqueux et organique.
Le modèle metallo-enzyme dispose d’une très forte efficacité
catalytique contrairement aux lanthanides seuls dans l’eau pure et ceci
sans perte de catalyseurs puisqu’il bénéficie d’un pouvoir de recyclage.
b) Les Calixarenes
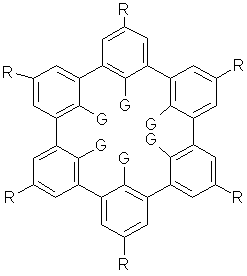 Définition :
Définition :
Composé macrocyclique capable d’adopter une conformation en panier. En général, un calixarène est formé à partir d’un phénol p-hydrocarbylé et de formaldéhyde. Le terme s’applique maintenant aussi aux dérivés de ces molécules. Ils peuvent comporter de manière générale 4 ou 6 cycles aromatiques.
Calix[6]arène :
R= n-C4H9 ou n-C6H13 G=OSO3Na ou SO3Na
Principales applications :
Calixarènes
bioactifs :
Les études sur les calix-arènes
bioactifs portent surtout sur le mimétisme des glycosylaminoglycannes
par les calix-arènes anioniques. Les études ont
portés sur les interactions entre ces molécules avec des acides-aminées des
peptides et plus récemment avec des protéines. Afin d'amener ces travaux aux
applications bio-médicales une programme d'étude de la
toxicité de ces molécules a été mise en place.
Domaine nucléaire :
L'idéal serait de
désactiver les déchets radioactifs en les enfermant dans une sorte de piège
chimique pour les trier et les manipuler. Des chercheurs du CEA et de
l'université de Strasbourg ont peut-être trouvé une solution pratique et
efficace. Il ne s'agit pas encore de désactiver tous types de substances
radioactives mais la méthode proposée semble donner satisfaction pour le césium
à longue durée de vie. Cet élément se trouvait en quantité abondante dans les retombées
de Tchernobyl et il continue de polluer les sols et les pâturages européens
depuis 8 ans. Les chercheurs du CEA ont réussi en laboratoire à piéger le
césium grâce aux calixarènes qui agissent comme des
pinces chimiques sélectives. Lorsque les calixarènes
se trouvent en solution et en présence de césium radioactif elles ont une
étonnante propriété : elle extraient le césium de la solution, l'enferment dans
le calixarène et le relâchent ensuite sans que leurs
propriétés n'en soient affectées. On peut ainsi les réutiliser sans les
détruire. Le rendement de l'opération est lui aussi extraordinaire car il
atteint 99%. Pour le moment, seuls le césium 135 et 137 dont la durée de vie
atteint une trentaine d'année on fait l'objet des expériences, mais d'autres
substances radioactives seront prochainement testées. Le passage à des
quantités industrielles n'interviendra pas avant une dizaine d'années.
Utilisation des calixarènes pour la réaction de Mukaiyama :
La réaction se fait à l’intérieur du
site hydrophobe du calixarène. Les calixarènes utilisés sont créés grâce à des benzènes
portant à la fois un groupement alkyle et un groupement sulfonyle.
c) Les Ethers couronnes :
Définition :
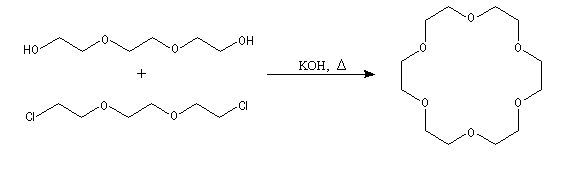
Exemple
de synthèse d’un éther couronne
Les éthers-couronnes sont
des composés macrocycliques contenant des atomes d'oxygène O (chaîne
polyéthylène glycol cyclisée) dans leur structure cyclique et qui présentent la
propriété de recevoir des ions de charge électrique positive (cations) à
l'intérieur de leur cavité.
Principales applications :
domaine
de la chimie des alcalins :
Les éthers couronnes font partie des rares complexants de ces éléments. Les éthers-couronnes, ayant
généralement tendance à se dissoudre dans l'eau, ne sont utilisables en
extraction liquide-liquide qu'après renforcement de leur caractère hydrophobe
par ajout de groupements benzo ou cyclohexano.
Leur pouvoir extractant est malgré tout insuffisant
pour leur permettre de retirer seuls le césium d'une solution très acide.
Domaine des polymères :
D'une
manière générale ces polymères présentent de bonnes propriétés complexantes. La conformation de la chaîne, due aux
diverses interactions et à l'encombrement stérique, peut cependant en modifier
les propriétés. Diverses applications de ces polymères sont possibles. Ils sont
utilisés en chromatographie (en tant que matériaux de la colonne) pour la
rétention des ions mais aussi des composés organiques et inorganiques. Les plus
intéressantes sont celles dont les polymères sont accrochés sur un support
insoluble. Lorsque les polymères jouent le rôle de catalyseurs dans le
transfert de phase, il n'est plus nécessaire de purifier la phase organique
pour en retirer ces derniers. Ceci permet une durée d'exploitation plus longue
du catalyseur (Pas de perte par extraction).
Utilisation des éthers-couronnes pour la réaction de Mukaiyama :
Les éthers
couronnes de la même manière que les autres surfactants sert de molécule hôte
pour que la réaction puisse se faire sans être perturbée par l’eau. La réaction
se fait donc à l’intérieur du site hydrophobe de l’éther-couronne.
V) Les applications récentes :
a) Synthèse de pyrroles faisant intervenir une
réaction de Mukaiyama :
Depuis une quinzaine d’année, les travaux effectués ont permis de mettre au point la synthèse de pyrroles en passant au préalable par une condensation aldolique croisée de type Mukaiyama. Les chimistes ont reportés en 1988 la synthèse de N-acyl-trialkylpyrroles à partir d’éthers silylés d’énol et du diméthylacétal (schéma). Cette synthèse a pour particularité de créer la liaison C-C en premier pour fournir le b-céto-acétal, puis la liaison C-N intervient en second lieu lors de la cyclisation menant au pyrroles.
Bilan de la
réaction :

Une voie de
synthèse de pyrroles tricycliques a également été réalisé
en passant par la réaction de Mukaiyama. Par ailleurs
en 1990, des chercheurs ont fait intervenir un a-azido-acétal
comme électrophile. Le produit de couplage avec l’éther d’énol
silylé donne un produit intermédiaire le b-céto-acétal,
qui une fois hydrogénée, libère l’amine et cyclise comme précédemment.
Bilan de la
réaction :
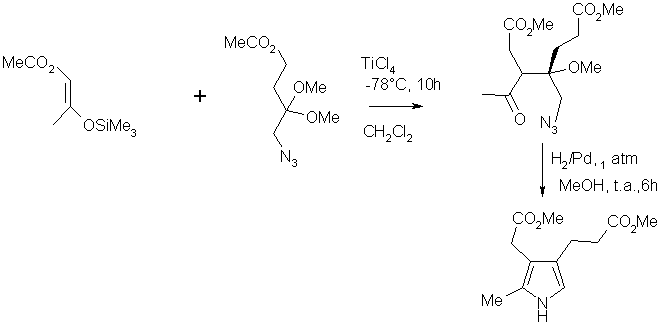
De telle réactions permettent d’imaginer de nouvelle voie de synthèse pour des composés comme le Porphobilinogène (PBG), qui est un intermédiaire destiné à la biosynthèse des tétrapyrroles. Ces pigments tétrapyrroliques jouent un rôle important dans les processus fondamentaux de la vie. On peut citer l’hème permettant le transport d’oxygène et d’électrons, où encore la chlorophylle, qui collecte les photons de la lumière et les transforme en énergie.
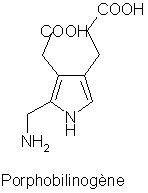
D’autres
voie de synthèse de ce composé ont été trouvé en
faisant intervenir un cyanure d’acyle comme électrophile, afin de compenser la
faible nucléophilie de l’éther silylé d’énol. [21]
b) Application à des médicaments :[17]
En 1990, des chercheurs ont montré que cette réaction peut-être énantiosélective, pour un éther d’énol silylé chiral ou un composé carbonylé chiral, ou diastéréoselective, si les réactifs sont chiraux. A l’heure actuelle, cette méthode a permis de synthétiser des antibiotiques.
En effet, le placlitaxel ou taxol appartient à la famille des taxanes qui sont une nouvelle classe d’agents anticancéreux des plus prometteurs. Le placlitaxel a été isolé en 1971 à partir de l’écorce du tronc de l’if du pacifique (Taxus brevifolia) qui est un conifère que l’on retrouve surtout dans les anciennes forêts du nord-ouest des Etats-Unis. Le grand intérêt tient d’une part à un mécanisme d’action original, au prix d’une toxicité actuellement bien contrôlée, et d’autre part à une efficacité dans les cancers devenus chimiorésistants, en particulier les cancers ovariens et du sein.
Différentes
voies de synthèse permettent d’obtenir le taxol à partir de réactions de Mukaiyama.
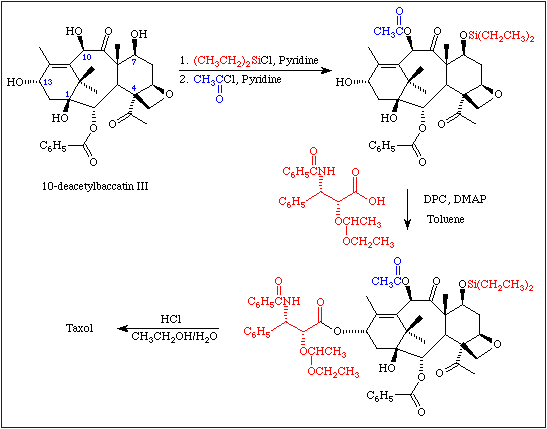
Etape
final de la réaction permettant d’obtenir le
taxol :
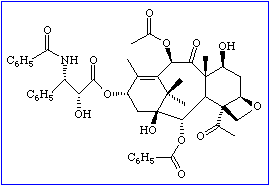 Molécule de taxol :
Molécule de taxol :
c) Synthèse de polymères grâce à la réaction de Mukaiyama
Il existe 2 types d’intérêt pour ces polymères donc 2 types de synthèses différentes :
Polymères
d’intérêt biologique :
Les motifs
du propionate sont difficiles à obtenir. L’intérêt de
l’aldolisation de Mukaiyama
est qu’elle permet une très grande stéréoséléctivité
et donc la synthèse des motifs 2,3-anti-3,4-anti et 2,3-anti-3,4-syn du propionate. L’intérêt de cette synthèse est de synthétiser
des composés biologiquement très importants : les polyketides.
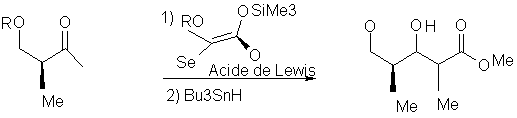
Cette réaction se fait en utilisant un éther d’énol silylé possédant en b un
groupement sélénium benzylé en présence d’un acide de
Lewis à base de bore.
Polymères
énantiomériquement purs :
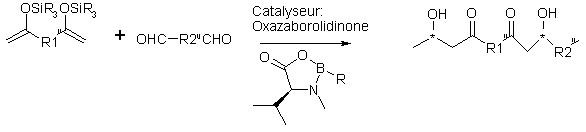
Depuis
1998, Shinichi et al. ont
étudié la synthèse de ces polymères grâce à des catalyseurs chiraux, les oxazaborolidinones. Ces catalyseurs originaux présentent
l’intérêt d’avoir une chaîne principale chirale. Cette synthèse permet de créer
pour la première fois des polymères optiquement actifs à base d’aldols. On
trouve un rendement moyen de 90% avec une stéréoséléctivité
d’environ 66%. Ces chercheurs ont développé une méthode basée sur les spectres
RMN 1H de la molécule pour déterminer la pureté optique de ces
polymères (voir annexe 1). Les réactions
ont été étudiées entre –20°C et –78°C.
Il existe
des dendrimères solubles contenant aussi des liaisons
Sc mais les dendrimères que
nous utiliserons ici sont insolubles car le scandium est en liaison pontante
entre les dendrimères. On les utilisera donc comme
catalyseurs hétérogènes, ils présentent l’avantage d’être très facilement
recyclables. Pour obtenir ces dendrimères, on utilise
une solution commerciale de dendrimères que l’on
traite par sulfonation avec Tf2O/Et3N puis on crée la
liaison pontante avec Sc(OTf)3 dans le THF.
Ensuite on effectue un traitement pour éviter l’accumulation des charges sur sa
surface. Même avec les dendrimères catalytiques il
est obtenu un rendement de 88%. On obtient un rendement et une stéréoséléctivité comparable à ceux que l’on obtient avec Sc(OTf)3 dans un solvant anhydre comme CH2Cl2/CH3CN
(2/1). Les dendrimères sont un excellent catalyseur
pour la réaction de mukaiyama dans l’eau pure car ils
permettent un rendement excellent ainsi qu’une très grande stéréoséléctivité
(quasiment complète).
Références Bibliographiques :
- Mukaiyama, Teruaki ; Narasaka, Koichi ; Banno, Kazuo.
New Aldol Type Reaction. Chemistry
Letters, 1973, pp. 1011-1014.
- Mukaiyama, Teruaki ; Banno, Kazuo; Narasaka,
Koichi.
New Cross-Aldol Reactions.
Reactions of Silyl Enol
Ethers with Carbonyl Compounds Activated by Titanium Tetrachloride. Jascat; Journal of the American Chemical Society;
EN; 96, 1974, pp. 7503-7509.
3. Munoz-Muniz, Omar; Quintanar-Audelo, Martina ; Juaristi, Eusebio.
Reexamination of CeCl3 and Incl3 as Activators in the Diastereoselective Mukaiyama Aldol Reaction in Aqueous Media. J. Org. Chem., 2003, n° 68, pp. 1622-1625.
4. Kobayashi, Shu; Nagayama,
Satoshi; Busujima, Tsuyoshi. Lewis Acid Catalysts Stable in Water. Correlations and
Exchange Rate Constants for Substitution of Inner-Sphere Water Ligands. Journal of the American Chemical Society,
1998, vol.120, n° 32, pp.8287-8288.
- Loh, Teck-Peng; Pei, Jian; Koh, Kevin Siong-Ve; Cao, Guo-Qiang; Li, Xu-Ran.
Indium-trichloride catalysed
Mukaiyama-aldol reaction in Water: solubility,
aggregation and internal pressure effect. Tetrahedron Letters, 1997, vol. 38, n° 19, pp. 3465-3468.
6. Loh, Teck-peng; Pei, Jian; Cao, Guo-Qiang.
Indium trichloride catalyzed Mukaiyama aldol reaction in Water.
Chemical Communications (Cambridge), 1996, n° 15, pp. 1819-1820.
7.
Li, Hui-jing Tian,
Hong-Yu; Chen, Yong-Jun ; “et all”.
Novel chiral gallium Lewis acid catalysts with semi-crown ligands for aqueous asymmetric Mukaiyama
aldol reactions. Chem. Comm., 2002, pp.
2994-2995.
- Reetz, Manfred T.; Giebel,
Dirk.
Cross-linked scandium-containing dendrimers:
a new class of heterogeneous catalysts.
Angewandte Chemie, International Edition, 2000, vol. 39, n° 14, pp. 2498-2501.
9. Manabe, Kei; Kobayashi, Shu.
Remarkable enhancement of reactivity by Broensted acids in aldol
reactions mediated by Lewis acid-surfactant-combined catalysts in Water. Tetrahedron Letters, 1999,
vol. 40, n° 19, pp. 3773-3776.
10. Nishikido, Joji; Nanbo, Masayuki; Yoshida, Akihiro; “et al”.
Metallo-enzyme model in pure Water: Cyclodextrin-lanthanide
tris(perfluoroalkanesulfonyl)methide and bis(perfluoroalkanesulfonyl)amide complexes. Synlett, 2002, n° 10,
pp. 1613-1616.
- Tian,
H.-Y.; Chen, Y.-J.; Wang, D.; Bu, Y.-P.; Li, C.-J.
The effects of aromatic and aliphatic anionic
surfactants on Sc(OTf)3-catalyzed Mukaiyama
aldol reaction in Water. Tetrahedron Letters, 2001, vol. 42, n° 10,
pp. 1803-1805.
- Tian, Hong-Yu; Chen, Yong-Jun; Wang, Dong;
“et al”.
Calix[6]arene derivatives bearing sulfonate
and alkyl groups as surfactants in Sc(Otf)3-catalyzed
Mukaiyama aldol reactions
in Water. Tetrahedron Letters, 2000,
Vol. 41, n° 15,
pp. 2529-2532.
13. Kobayashi,
Shu; Hamada, Tomoaki; Nagayama, Satoshi; Manabe, Kei.
Lanthanide
Trifluoromethanesulfonate-catalyzed Asymmetric Aldol Reactions in Aqueous Media. Organic Letters, 2001, vol. 3, n° 2, pp. 165-167.
14. Yamashita, Yasuhiro; Ishitani, Haruro; Shimizu, Haruka; Kobayashi, Shu.
Highly
anti-Selective Asymmetric Aldol Reactions Using Chiral Zirconium Catalysts. Improvement of Activities,
Structure of the Novel Zirconium Complexes, and Effect of a Small Amount of
Water for the Preparation of the Catalysts.
Journal
of the American Chemical Society, 2002, vol. 124, pp. 3292-3302.
15. Mori, Yuichiro; Manabe, Kei; Kobayashi,
Shu.
Catalytic
use of a boron source for boron enolate mediated stereoselective aldol reactions
in Water. Angewandte
Chemie, International Edition, 2001, vol. 40, n° 15,
pp. 2815-2818.
16. Tian, Hong-Yu; Li, Hui-jing ; Chen, Yong-Jun ; “ et al”.
Development of Highly Effective Encapsulating Surfactants for Mukaiyama Aldol Reactions in Water. Ind. Eng. Chem. Res., 2002, n° 41, pp. 4523-4527.
- Jennewein, Stephan; D. Rithner,
Christopher; “ et al”.
Taxol biosynthesis: Taxane 13α-hydroxylase is
a cytochrome P450-dependent monooxygenase.
Proceedings of the National Academy of Sciences of the United States of
America, 2001, vol. 98, n° 24, pp. 13595-13600.
- Komura, Kenichi; Itsuno,
Shinichi ; Ito, Koichi.
Aldol polymerisation as a novel polyaddition based
on Mukaiyama aldol reaction
and its application to the synthesis of optically active polymer. Chem. Commun., 1999,
pp. 35-36.
- Itsuno, Schinichi; Komura, Kenichi.
Highly stereoselective
synthesis of chiral aldol
polymers using repeated asymmetric Mukaiyama aldol reaction. Tetrahedron Letters, 2002, vol. 58, pp. 8237-8246.
20.
Guindon, Yvan ; Prévost,
Michel ; Mochirian, Philippe ; “ et al”.
Synthesis of 2,3-Anti-3,4-anti and 2,3-anti-3,4-syn
Propionate Motifs: A Diastereoselective Tandem
Sequence of Mukaiyama and Free-Radical-based Hydrogen
Transfer Reactions. Organic Letters, 2002, vol. 4, n° 6, pp. 1019-1022.
21. Soldermann-Pissot,
Carole.
Synthèse
d’un précurseur stable du porphobilinogène : un
accès rapide et pratique au produit naturel. Thèse présentée à la faculté
des Sciences de l’Université de Neuchâtel, 2002, 300pp.